8 CARQ JADI YOUTUBER
Kamu suka banget nonton Youtube di handphone kamu? Pernah bermimpi bagaimana cara menjadi Youtuber gaming yang menghasilkan uang? Atau kamu memang sudah bercita-cita menjadi Youtuber?
Tenang guys! Apapun bisa kamu wujudkan jika kamu benar-benar bertekad melakukannya.
Kalau kamu bingung bagaimana cara menjadi Youtuber yang sukses seperti Raditya Dika atau Pew Die Pie, ada beberapa hal yang harus kamu perhatikan!
Jaka mempunyai tips yang dijamin berguna banget sebagai langkah awal untuk menjadi Youtuber sukses!
Mungkin di awal perjalanan kamu menjadi Youtuber akan terasa berat, maka jalani semua step by step tips dari Jaka ini!
Panduan Cara Menjadi Youtuber Sukses dan Kaya Raya
Setidaknya ada 8 langkah yang harus kamu ikuti sebelum akhirnya kamu bisa menjadi Youtuber yang sukses seperti Youtber idola kamu.
Ingat ya guys, kunci utama keberhasilan adalah kerja keras dan berdoa!
1. Buat Channel Youtube
Tentu saja, hal pertama yang harus kamu lakukan adalah membuat akun Youtube!
Sebenarnya dengan kamu membuat akun Gmail dan mensikronkannya dengan Youtube, secara otomatis kamu sudah membuat akun Youtube kamu sendiri kok!
Jaka sudah membahas secara khusus bagaimana cara membuat akun Youtube di PC dan Android dengan mudah lho!
Kamu bisa membaca artikelnya di bawah ini:
Cara Membuat Channel YouTube Mudah Di PC Dan Android Terbaru 2018
Kamu mau jadi Youtuber yang menghasilkan uang? Kamu harus bikin channel YouTube sendiri dulu guys. Ikutin aja panduan mudah cara membuat channel YouTube ini.
LIHAT ARTIKEL
2. Buat Konsep dan Ide
Setelah kamu membuat channel Youtube, maka langkah selanjutnya yang harus kamu lakukan supaya cara menjadi youtuber sukses kamu berhasil, kamu harus melakukan brainstorming!
Brainstorming yang Jaka maksud di sini adalah kamu harus benar-benar memikirkan secara matang mengenai konten apa yang akan kamu buat, personality apa yang ingin kamu tampilkan, dan lain-lain.
Jaka coba mencontohkan misalnya channel Youtube Jalantikus ys guys!
Channel jalantikus sendiri sudah mempunyai lebih dari 2,5 juta subscriber! Saat pertama kali channel Youtube Jalantikus dibuat, tim kita sudah memikirkan secara matang seperti apa channel ini nantinya.
Dari awal kamu harus bisa memastikan konten apa yang ingin kamu buat! channel Jalantikus misalnya dari awal berkomitmen untuk membuat konten mengenai informasi teknologi, gadget, tips& trick Android, hingga webseries.
Tujuannya apa? jalantikus ingin memberikan hiburan, pengetahuan, sekaligus mengedukasi penonton channel Youtube-nya agar bisa update dengan perkembangan zaman!
3. Pilih dan beli Kebutuhan Videografi
Sebenarnya agak sulit cara jadi youtuber modal hp saja! Karena untuk menciptakan konten yang bagus, butuh pengorbanan.
Tetapi, kamu bisa memulai vlog kecil-kecilan dimulai dari hasil rekaman kamera video HP kamu. Jangan pernah malu untuk berkreasi!
Kalau nanti kamu ada rejeki atau uang hasil tabungan sudah cukup, belilah perangkat atau gadget yang bisa membantu kamu dalam membuat konten video Youtube kamu.
Cari laptop, kamera, lighting hingga alat perekam yang bisa membantu kamu membuat video yang bagus.
Kamu bisa mengecek daftar harga kamera Nikon atau harga kamera Canon terlebih dahulu sebelum mebelinya agar budget kamu tidak jebol.
Nah, kalau kamu butuh laptop baru untuk mengedit video-video kamu, Jaka punya rekomendasi beberapa laptop plus harganya di bawah ini:
Daftar Harga Laptop Lenovo November 2018
(Update) Daftar harga laptop Lenovo terbaru di tahun 2019 beserta video review, gambar, fitur menarik dan spesifikasi lengkapnya untuk semua tipe!
LIHAT ARTIKEL
Daftar Harga Laptop HP Terbaru November 2018
(Update terbaru) Daftar harga laptop HP dengan Intel Core i3, i5 dan i7 baru maupun second atau bekas beserta spesifikasi lengkapnya.
LIHAT ARTIKEL
4. Membuat Konten yang Menarik
Nah sebenarnya ada jenis video Youtube yang paling menguntungkan apabila kamu membuatnya.
Tetapi sih menurut hemat Jaka, konten apapun ya
GUGUN AHMAD
Friday, October 11, 2019
Thursday, October 10, 2019
Sejarah Asia
Baca dalam bahasa lain
Pantau
Sunting
Selembar sutra Tiongkok dari abad ke-4 SM. Perniagaan sutra melalui Jalur Sutra menghubungkan berbagai negeri mulai dari Tiongkok, India, Asia Tengah dan Timur Tengah, hingga Eropa dan Afrika.
Sejarah Asia dapat dilihat sebagai sejarah kolektif dari tiga kawasan pesisir benua Asia, yakni Asia Timur, Asia Selatan, dan Timur Tengah, yang dihubungkan oleh bentangan stepa yang luas di pedalaman Eurasia.
Kawasan-kawasan pesisir adalah tempat lahirnya peradaban-peradaban terawal di dunia. Di setiap kawasan pesisir, peradaban umat manusia tumbuh dan berkembang di sekitar lembah-lembah sungai yang subur. Tanah di lembah-lembah sungai yang subur ini kaya akan unsur hara sehingga dapat ditanami bermacam-macam jenis umbi-umbian. Peradaban-peradaban yang tumbuh di Mesopotamia, Lembah Sungai Indus, dan Tiongkok memiliki banyak kemiripan dan agaknya saling bertukar teknologi serta gagasan, misalnya matematika dan roda. Hasil budaya lain seperti tulisan agaknya berkembang secara mandiri di masing-masing kawasan. Kota-kota, negara-negara, dan kelak kekaisaran-kekaisaran berkembang di lembah-lembah sungai yang subur di kawasan pesisir benua ini.
Kawasan stepa sudah sejak lama dihuni oleh kaum pengembara berkuda. Dari tengah-tengah kawasan itu, mereka sanggup berkelana sampai ke seluruh pelosok benua Asia. Kawasan utara Eurasia, yang meliputi sebagian besar daerah Siberia, adalah kawasan yang tidak dapat dimasuki para pengembara stepa ini karena memiliki rintangan alam berupa hutan-hutan rimba dan tundra. Di Siberia, kawasan-kawasan ini berpenduduk sangat jarang.
Kawasan pedalaman dan kawasan pesisir dipisahkan oleh pegunungan-pegunungan dan gurun-gurun. Pegunungan Kaukasus, Pegunungan Himalaya, Gurun Karakum, dan Gurun Gobi merupakan rintangan alam yang hanya dapat diterobos oleh kaum pengembara berkuda dari stepa dengan susah-payah. Meskipun sudah jauh lebih maju di bidang teknologi dan budaya, kaum penghuni kota tidak mampu berbuat banyak untuk mempertahankan diri terhadap serangan gerombolan-gerombolan berkuda dari stepa. Akan tetapi kawasan pesisir tidak memiliki bentangan padang rumput yang cukup luas untuk menampung pasukan berkuda dalam jumlah besar, sehingga setelah menaklukkan negari-negari di Timur Tengah, kaum pengembara berkuda terpaksa harus beradaptasi dengan cara hidup masyarakat setempat.
Sejarah Asia juga akan membahas tentang perkembangan-perkembangan besar yang terjadi di berbagai kawasan lain di dunia, dan peristiwa-peristiwa besar di Asia yang turut berdampak pada kawasan-kawasan itu. Di antaranya adalah kegiatan niaga di Jalur Sutra yang telah menjadi sarana penyebaran budaya, bahasa, agama, dan wabah penyakit di sepanjang jalur niaga Afrika-Eurasia. Kemajuan besar lain adalah penemuan serbuk mesiu di Tiongkok pada Abad Pertengahan yang menjadi cikal bakal kemajuan dalam cara-cara berperang melalui penggunaan senjata api.
Wednesday, January 14, 2015
manfaat gunung untuk menopang kehidupan bumi
KEAJAIBAN GUNUNG MENURUT AL-QURAN
وَجَعَلْنَا فِي الْأَرْضِ رَوَاسِيَ أَن تَمِيدَ بِهِمْ وَجَعَلْنَا فِيهَا فِجَاجًا سُبُلًا لَّعَلَّهُمْ يَهْتَدُونَ
“Dan telah Kami jadikan di bumi ini gunung-gunung yang kokoh supaya bumi itu (tidak) goncang bersama mereka dan telah Kami jadikan (pula) di bumi itu jalan-jalan yang luas, agar mereka mendapat petunjuk” (QS. Al-Anbiya (21):31)
Al-Qur’an mengarahkan perhatian kita pada fungsi geologis penting dari gunung.
Ayat tersebut menyatakan bahwa gunung-gunung berfungsi meredam guncangan di permukaan Bumi. Kenyataan ini tidak diketahui oleh siapa pun pada masa ketika Al-Qur’an diturunkan. Bahkan, fakta ini baru terungkap sebagai hasil riset geologi modern. Awalnya, manusia mengira gunung-gunung hanyalah tonjolan di permukaan bumi. Namun, para ilmuwan mendapati kenyataan lain dan bagian yang disebut sebagai akar gunung menghunjam ke bawah mencapai 10-15 kali tinggi gunung itu sendiri.
Dengan kondisi ini, gunung memainkan peran serupa dengan paku atau pasak yang ditancapkan untuk mendirikan tenda. Sebagai contoh, Gunung Everest, dengan ketinggian kira-kira 9 km di atas permukaan bumi, mempunyai akar lebih dari 125 km. Gunung-gunung muncul sebagai hasil pergerakan dan tumbukan dari lempengan-lempengan raksasa yang membentuk kerak Bumi. Ketika dua lempengan bertumbukan, lempengan yang lebih kuat menyelip di bawah lempengan satunya, sementara yang di atas melipat dan membentuk dataran tinggi dan gunung.
Lapisan bawah bergerak di bawah permukaan dan membentuk perpanjangan yang dalam ke bawah. Ini berarti gunung mempunyai bagian menghunjam jauh ke bawah yang tak kalah besarnya dengan yang tampak di permukaan Bumi. Profesor Siaveda, ahli geologi kelautan terkemuka, berkomentar mengenai gunung yang memiliki akar ini: Perbedaan dasar antara gunung dataran dan gunung di laut terletak pada materinya. Namun, karakteristik serupa adalah, keduanya memiliki akar yang menahan tubuh mereka yang menjulang. Pada gunung-gunung daratan, materi ringan dengan kekerapan rendah dari gunung dihunjamkan ke dalam Bumi sebagai akar. Pada gunung-gunung lautan, ada juga materi ringan yang menopang gunung sebagai akar. Dengan demikian, fungsi akar-akar ini adalah untuk menopang gunung menurut hukum Archimedes.
Lebih jauh, Dr. Frank Press, mantan Presiden Akademi Sains Nasional, AS, dalam bukunya berjudul Earth yang masih digunakan sebagai buku teks di pelbagai universitas, menyatakan bahwa gunung-gunung ibarat pasak dan tertanam jauh di bawah permukaan bumi.
Dalam tulisan ilmiah, struktur gunung digambarkan sebagai berikut:
“Pada bagian benua yang lebih tebal, seperti pada jajaran pegunungan, kerak bumi akan terbenam lebih dalam ke dalam lapisan magma.” (General Science, Carolyn Sheets, Robert Gardner, Samuel F. Howe; Allyn and Bacon Inc. Newton, Massachusetts, 1985, s. 305)
Dalam sebuah ayat, peran gunung seperti ini diungkapkan melalui sebuah perumpamaan sebagai “pasak”:
أَلَمْ نَجْعَلِ الْأَرْضَ مِهَادًا
وَالْجِبَالَ أَوْتَادًا
“Bukankah Kami telah menjadikan bumi itu sebagai hamparan?, dan gunung-gunung sebagai pasak?” (QS. An-Naba (78):6-7)
Dengan kata lain, gunung-gunung menggenggam lempengan-lempengan kerak bumi dengan memanjang ke atas dan ke bawah permukaan bumi pada titik-titik pertemuan lempengan-lempengan ini. Dengan cara ini, mereka memancangkan kerak bumi dan mencegahnya dari terombang-ambing di atas lapisan magma atau di antara lempengan-lempengannya. Singkatnya, kita dapat menyamakan gunung dengan paku yang menjadikan lembaran-lembaran kayu tetap menyatu.
Fungsi pemancangan dari gunung dijelaskan dalam tulisan ilmiah dengan istilah “isostasi”. Isostasi bermakna sebagai berikut:
“Isostasi: kesetimbangan dalam kerak bumi yang terjaga oleh aliran materi bebatuan di bawah permukaan akibat tekanan gravitasi.” (Webster’s New Twentieth Century Dictionary, 2. edition “Isostasy”, New York, s. 975)
Peran penting gunung yang ditemukan oleh ilmu geologi modern dan penelitian gempa, telah dinyatakan dalam Al Qur’an berabad-abad lampau sebagai suatu bukti Hikmah Maha Agung dalam ciptaan Allah.
(Dikutip dari Al-Qur’an Miracle the Reference)
وَجَعَلْنَا فِي الْأَرْضِ رَوَاسِيَ أَن تَمِيدَ بِهِمْ وَجَعَلْنَا فِيهَا فِجَاجًا سُبُلًا لَّعَلَّهُمْ يَهْتَدُونَ
“Dan telah Kami jadikan di bumi ini gunung-gunung yang kokoh supaya bumi itu (tidak) goncang bersama mereka dan telah Kami jadikan (pula) di bumi itu jalan-jalan yang luas, agar mereka mendapat petunjuk” (QS. Al-Anbiya (21):31)
Al-Qur’an mengarahkan perhatian kita pada fungsi geologis penting dari gunung.
Ayat tersebut menyatakan bahwa gunung-gunung berfungsi meredam guncangan di permukaan Bumi. Kenyataan ini tidak diketahui oleh siapa pun pada masa ketika Al-Qur’an diturunkan. Bahkan, fakta ini baru terungkap sebagai hasil riset geologi modern. Awalnya, manusia mengira gunung-gunung hanyalah tonjolan di permukaan bumi. Namun, para ilmuwan mendapati kenyataan lain dan bagian yang disebut sebagai akar gunung menghunjam ke bawah mencapai 10-15 kali tinggi gunung itu sendiri.
Dengan kondisi ini, gunung memainkan peran serupa dengan paku atau pasak yang ditancapkan untuk mendirikan tenda. Sebagai contoh, Gunung Everest, dengan ketinggian kira-kira 9 km di atas permukaan bumi, mempunyai akar lebih dari 125 km. Gunung-gunung muncul sebagai hasil pergerakan dan tumbukan dari lempengan-lempengan raksasa yang membentuk kerak Bumi. Ketika dua lempengan bertumbukan, lempengan yang lebih kuat menyelip di bawah lempengan satunya, sementara yang di atas melipat dan membentuk dataran tinggi dan gunung.
Lapisan bawah bergerak di bawah permukaan dan membentuk perpanjangan yang dalam ke bawah. Ini berarti gunung mempunyai bagian menghunjam jauh ke bawah yang tak kalah besarnya dengan yang tampak di permukaan Bumi. Profesor Siaveda, ahli geologi kelautan terkemuka, berkomentar mengenai gunung yang memiliki akar ini: Perbedaan dasar antara gunung dataran dan gunung di laut terletak pada materinya. Namun, karakteristik serupa adalah, keduanya memiliki akar yang menahan tubuh mereka yang menjulang. Pada gunung-gunung daratan, materi ringan dengan kekerapan rendah dari gunung dihunjamkan ke dalam Bumi sebagai akar. Pada gunung-gunung lautan, ada juga materi ringan yang menopang gunung sebagai akar. Dengan demikian, fungsi akar-akar ini adalah untuk menopang gunung menurut hukum Archimedes.
Lebih jauh, Dr. Frank Press, mantan Presiden Akademi Sains Nasional, AS, dalam bukunya berjudul Earth yang masih digunakan sebagai buku teks di pelbagai universitas, menyatakan bahwa gunung-gunung ibarat pasak dan tertanam jauh di bawah permukaan bumi.
Dalam tulisan ilmiah, struktur gunung digambarkan sebagai berikut:
“Pada bagian benua yang lebih tebal, seperti pada jajaran pegunungan, kerak bumi akan terbenam lebih dalam ke dalam lapisan magma.” (General Science, Carolyn Sheets, Robert Gardner, Samuel F. Howe; Allyn and Bacon Inc. Newton, Massachusetts, 1985, s. 305)
Dalam sebuah ayat, peran gunung seperti ini diungkapkan melalui sebuah perumpamaan sebagai “pasak”:
أَلَمْ نَجْعَلِ الْأَرْضَ مِهَادًا
وَالْجِبَالَ أَوْتَادًا
“Bukankah Kami telah menjadikan bumi itu sebagai hamparan?, dan gunung-gunung sebagai pasak?” (QS. An-Naba (78):6-7)
Dengan kata lain, gunung-gunung menggenggam lempengan-lempengan kerak bumi dengan memanjang ke atas dan ke bawah permukaan bumi pada titik-titik pertemuan lempengan-lempengan ini. Dengan cara ini, mereka memancangkan kerak bumi dan mencegahnya dari terombang-ambing di atas lapisan magma atau di antara lempengan-lempengannya. Singkatnya, kita dapat menyamakan gunung dengan paku yang menjadikan lembaran-lembaran kayu tetap menyatu.
Fungsi pemancangan dari gunung dijelaskan dalam tulisan ilmiah dengan istilah “isostasi”. Isostasi bermakna sebagai berikut:
“Isostasi: kesetimbangan dalam kerak bumi yang terjaga oleh aliran materi bebatuan di bawah permukaan akibat tekanan gravitasi.” (Webster’s New Twentieth Century Dictionary, 2. edition “Isostasy”, New York, s. 975)
Peran penting gunung yang ditemukan oleh ilmu geologi modern dan penelitian gempa, telah dinyatakan dalam Al Qur’an berabad-abad lampau sebagai suatu bukti Hikmah Maha Agung dalam ciptaan Allah.
(Dikutip dari Al-Qur’an Miracle the Reference)
Wednesday, November 7, 2012
asal usul ninja
Ninja atau Shinobi (忍者 atau 忍び?) (dalam bahasa Jepang, secara harfiah berarti "Seseorang yang bergerak secara rahasia") adalah seorang mata - mata zaman feodal di Jepang yang terlatih dalam seni ninjutsu (secara kasarnya "seni pergerakan sunyi") Jepang. Ninja, seperti samurai, mematuhi peraturan khas mereka sendiri, yang disebut ninpo. Menurut sebagian pengamat ninjutsu, keahlian seorang ninja bukanlah pembunuhan tetapi penyusupan. Ninja berasal dari bahasa Jepang yang berbunyi nin yang artinya menyusup. Jadi, keahlian khusus seorang ninja adalah menyusup dengan atau tanpa suara.
 Ninja biasanya segera dikaitkan dengan sosok yng terampil beladiri,
ahli menyusup dan serba misterius seperti yang tampak di dalam film atau manga (komik Jepang). Kata ninja terbentuk dari dua kata yaitu nin (忍?) dan sha (者?) yang masing-masing artinya adalah "tersembunyi" dan "orang". Jadi ninja adalah mata-mata profesional pada zaman feudal
jepang. Sejarah ninja juga sangat sulit dilacak. Info mengenai
keberadaan mereka tersimpan rapat-rapat dalam dokumen-dokumen rahasia.
Ninja biasanya segera dikaitkan dengan sosok yng terampil beladiri,
ahli menyusup dan serba misterius seperti yang tampak di dalam film atau manga (komik Jepang). Kata ninja terbentuk dari dua kata yaitu nin (忍?) dan sha (者?) yang masing-masing artinya adalah "tersembunyi" dan "orang". Jadi ninja adalah mata-mata profesional pada zaman feudal
jepang. Sejarah ninja juga sangat sulit dilacak. Info mengenai
keberadaan mereka tersimpan rapat-rapat dalam dokumen-dokumen rahasia.
Ninja juga bisa diartikan sebagai nama yang diberikan kepada seseorang yang menguasai dan mendalami seni bela diri ninjutsu. Nin artinya pertahanan dan jutsu adalah seni atau cara. Kata ninja juga diambil dari kata ninpo. Po artinya adalah falsafah hidup atau dengan kata lain ninpo adalah falsafah tertinggi dari ilmu beladiri ninjutsu yang menjadi dasar kehidupan seorang ninja. Jadi ninja akan selalu waspada dan terintregasi pada prinsip ninpo.
Ninja adalah mata-mata profesional di zaman ketika para samurai masih memegang kekuasaan tertinggi di pemerintahan Jepang pada abad ke-12. Pada abad ke-14 pertarungan memperebutkan kekuasaan semakin memanas, informasi tentang aktivitas dan kekuatan lawan menjadi penting, dan para ninja pun semakin aktif. Para ninja dipanggil oleh daimyo untuk mengumpulkan informasi, merusak dan menghancurkan gudang persenjataan ataupun gudang makanan, serta untuk memimpin pasukan penyerbuan di malam hari. Karena itu ninja memperoleh latiham khusus. Ninja tetap aktif sampai Zaman Edo (1600-1868), dimana akhirnya kekuasaan dibenahi oleh pemerintah di Zaman Edo.
Seni nonuse atau yang biasa disebut seni bertindak diam-diam adalah suatu praktik keagamaan yang dilakukan oleh para pendeta yang pada saat itu bertugas memberikan info kepada orang-orang di pemerintahan. Sekitar tahun 645, pendeta-pendeta tersebut menyempurnakan kemampuan bela diri dan mulai menggunakan pengetahuan mereka tentang nonuse untuk melindungi diri dari intimidasi pemerintah pusat.
Pada tahun 794-1192, kehidupan masyarakat Jepang mulai berkembang dan melahirkan kelas-kelas baru berdasarkan kekayaan. Keluarga kelas ini saling bertarung satu sama lain dalam usahanya menggulingkan kekaisaran. Kebutuhan keluarga akan pembunuh dan mata-mata semakin meningkat untuk memperebutkan kekuasaan. Karena itu permintaan akan para praktisi nonuse semakin meningkat. Inilah awal kelahiran ninja. Pada abad ke-16 ninja sudah dikenal dan eksis sebagai suatu keluarga atau klan di kota Iga atau Koga. Ninja pada saat itu merupakan profesi yang berhubungan erat dengan intelijen tingkat tinggi dalam pemerintah feodal para raja di jepang. Berdasarkan hal itu, masing-masing klan memiliki tradisi mengajarkan ilmu beladiri secara rahasia dalam keluarganya saja. Ilmu beladiri yang kemudian dikenal dengan nama ninjutsu. Dalah ilmu yang diwariskan dari leluhur mereka dan atas hasil penyempurnaan seni berperang selama puluhan generasi. Menurut para ahli sejarah hal itu telah berlangsung selama lebih dari 4 abad. Ilmu itu meliputi filsafat FUDOSHIN, spionase, taktik perang komando, tenaga dalam, tenaga supranatural, dan berbagai jenis bela diri lain yang tumbuh dan berkembang menurut zaman.
Namun ada sebuah catatan sejarah yang mengatakan bahwa sekitar abad ke-9 terjadi eksodus dari Cina ke Jepang. Hal ini terjadi karena runtuhnya dinasti Tang dan adanya pergolakan politik. Sehingga banyak pengungsi yang mencari perlindungan ke jepang.sebagian dari mereka adalah jendral besar, prajurit dan biksu. Mereka menetap di provinsi Iga, di tengah pulau Honshu. Jendral tersebut antara lain Cho Gyokko, Ikai Cho Busho membawa pengetahuan mereka dan membaur dengan kebudayaan setempat. Strategi militer, filsafat kepercayaan, konsep kebudayaan, ilmu pengobatan tradisional, dan falsafah tradisional. Semuanya menyatu dengan kebiasaan setempat yang akhirnya membentuk ilmu yang bernama ninjutsu.
 Gerakan beladiri ninjutsu hanya tendangan, lemparan, patahan, dan
serangan. Kemudian dilengkapi dengan teknik pertahanan diri seperti
bantingan, berputar dan teknik bantu seperti meloloskan diri, mengendap,
dan teknik khusus lainnya. Namun, dalam praktiknya ninja menghindari
kontak langsung dengan lawannya, oleh karena itu berbagai alat lempar,
lontar, tembak, dan penyamaran lebih sering digunakan. Berbeda dengan
seni beladiri lain, ninjutsu mengajarkan teknik spionase, sabotase,
melumpuhkan lawan, dan menjatuhkan mental lawan. Ilmu tersebut digunakan
untuk melindungi keluarga ninja mereka. Apa yang dilakukan ninja memang
sulit dimengerti. Pada satu sisi harus bertempur untuk melindungi, di
sisi lain ninja harus mengutamakan kecerdikan saat menggunakan jurus
untuk menghadapi lawan. Di sisi lain ajaran ninpo memberi petunjuk bahwa
salah satu tujuan ninjutsu adalah mengaktifkan indra keenam mereka.
paduan intuisi dan kekuatan fisik pada jangka waktu yang lama
memungkinkan para ninja untuk mengaktifkan indra keenamnya. Sehingga
dapat mengenal orang lain dengan baik dan mengerti berbagai persoalan
dalam berbagai disiplin ilmu.
Gerakan beladiri ninjutsu hanya tendangan, lemparan, patahan, dan
serangan. Kemudian dilengkapi dengan teknik pertahanan diri seperti
bantingan, berputar dan teknik bantu seperti meloloskan diri, mengendap,
dan teknik khusus lainnya. Namun, dalam praktiknya ninja menghindari
kontak langsung dengan lawannya, oleh karena itu berbagai alat lempar,
lontar, tembak, dan penyamaran lebih sering digunakan. Berbeda dengan
seni beladiri lain, ninjutsu mengajarkan teknik spionase, sabotase,
melumpuhkan lawan, dan menjatuhkan mental lawan. Ilmu tersebut digunakan
untuk melindungi keluarga ninja mereka. Apa yang dilakukan ninja memang
sulit dimengerti. Pada satu sisi harus bertempur untuk melindungi, di
sisi lain ninja harus mengutamakan kecerdikan saat menggunakan jurus
untuk menghadapi lawan. Di sisi lain ajaran ninpo memberi petunjuk bahwa
salah satu tujuan ninjutsu adalah mengaktifkan indra keenam mereka.
paduan intuisi dan kekuatan fisik pada jangka waktu yang lama
memungkinkan para ninja untuk mengaktifkan indra keenamnya. Sehingga
dapat mengenal orang lain dengan baik dan mengerti berbagai persoalan
dalam berbagai disiplin ilmu.
Di dalam ninpo terdapat teknik beladiri tangan kosong (taijutsu), teknik pedang (kenjutsu), teknik bahan peledak dan senjata api (kajutsu), teknik hipnotis (saimonjutsu), dan teknik ilusi(genjutsu). Pada aliran Togakure Ryu dikenal adanya latihan olah energi yang disebut Kuji Kiri. Prinsipnya adalah penggabungan antara kekuatan fisik dan mental. Penyaluran energi yang tepat dari tenaga kuji kiri dapat bersifat menghancurkan, namun di sisi lain jika digunakan untuk olah pikir dapat digunakan untuk menyelesaikan persoalan yang pelik.
Ninjutsu akan sia-sia jika ninja tidak memiliki mental dan spiritual yang kuat. Untuk itu ninja harus menguasai Kuji-in, yaitu kekuatan spiritual dan mental berdasarkan simbol yang terdapat di telapak tangan yang dipercaya menjadi saluran energi. Simbol di tangan di ambil dari praktik pada massa awal penyebaran agama Buddha. Kuji-in digunakan untuk membangun kepercayaan diri dan kekuatan seorang ninja. Kuji-in mampu meningkatkan kepekaan terhadap keadaan bahaya dan mendeteksi adanya kematian.
Dari 81 simbol yang ada, hanya 9 yang utama, yaitu rin(memberi kekuatan tubuh), hei (memberi kekuatan menyamarkan kehadiran seseorang), Toh (menyeimbangkan bagian padat dan cair pada tubuh), sha (kemampuan menyembuhkan), kai(memberi kontrol menyeluruh terhadap fungsi tubuh), jin(meningkatkan kekuatan telepati), retsu (memberi kekuatan telekinetik), zai (meningkatkan keselarasan terhadap alam), dan zen (memberi pencerahan pikiran dan pemahaman). Seorang ninja akan menjadi master sejati dengan menguasai simbol-simbol ini.
Walaupun terdapat banyak keluarga ninja di Jepang, baru sekitar tahun enam puluhan keluarga ninja baru dapat di dekati oleh orang luar. Pada tahun 1960 televisi jepang menayangkan laporan dokumentasi dan sejarah ninja. Setelah itu salah satu aliran yang dapat membuka diri dan memperkenalkan ninja ke dunia luar adalah aliran togakure-ryu dengan pewaris dari generasi ke 34, masaaki hatsumi,.yang profesi sehari-harinya adalah seorang tabib ahli penyembuhan dan pengobatan tulang. Pada tahun 1978 ninjutsu berhasil di publikasikan dan diajarkan ke amerika oleh stephen k. hayes. Sejak saat itu ninjutsu menjadi cabang beladiri yang paling banyak diminati.
 Ninja diharuskan untuk bisa bertahan hidup di tengah alam, karena itu
mereka menjadi terlatih secara alamiah untuk mampu membedakan tumbuhan
yang bisa dimakan, tumbuhan racun, dan tumbuhan obat. Mereka memiliki
metode cerdik untuk mengetahui waktu dan mata angin. Ninja menggunakan
bintang sebagai alat navigasi mereka ketika menjalankan misi di malam
hari.mereka juga mahir memasang perangkap, memasak hewan, membangun
tempat berlindung, menemukan air dan membuat api.
Ninja diharuskan untuk bisa bertahan hidup di tengah alam, karena itu
mereka menjadi terlatih secara alamiah untuk mampu membedakan tumbuhan
yang bisa dimakan, tumbuhan racun, dan tumbuhan obat. Mereka memiliki
metode cerdik untuk mengetahui waktu dan mata angin. Ninja menggunakan
bintang sebagai alat navigasi mereka ketika menjalankan misi di malam
hari.mereka juga mahir memasang perangkap, memasak hewan, membangun
tempat berlindung, menemukan air dan membuat api.
Ninja memakai baju yang menutup tubuh mereka kecuali telapak tangan dan seputar mata. Baju ninja ini disebut shinobi shozoko. shinobi shozoko memiliki 3 warna. Baju warna hitam biasanya dipakai ketika melakukan misi di malam hari dan bisa juga sebagai tanda kematian yang nyata bagi sang target. Warna putih digunakan untuk misi di hari bersalju. Warna hijau sebagai kamuflase agar mereka tidak terlihat dalam lingkungan hutan.
Shinobi shozoko memiliki banyak kantong di dalam dan luarnya. Kantong ini digunakan untuk menyimpan peralatan kecil dan senjata yang mereka butuhkan, seperti racun, shuriken, pisau, bom asap dan lain-lain. Ninja juga membawa kotak P3K kecil tradisional, yang diisi dengan cairan dan minuman. Ninja juga memakai tabi yang mirip sepatu boot. Celah yang memisahkan jempol kaki dengan jari lainnya memudahkan ninja saat memanjat tali atau dinding.
Ninja wanita atau kunoichi yang biasanya bekerja dengan menggunakan kefemininan mereka ketika melakukan pendekatan pada sang target menggunakan manipulasi kejiwaan dan perang batin sebagai senjata mereka. mereka bisa mendekati target dan membunuhnya tanpa jejak. Kunoichi memiliki misi yang berbeda dengan ninja laki-laki. Mereka lebih sering dekat dengan target, sehingga mereka juga lebih sering menggunakan senjata jarak dekat seperti metsubishi, racun, golok, tali, dan tessen. Selain itu senjata-senjata tersebut juga praktis dibawa tanpa kelihatan.
Ninja memiliki senjata dalam berbagai jenis, bentuk, dan ukuran. Senjata yang biasanya dipakai adalah katana (pedang) dan sering diletakkan di punggung.[1] Senjata lempar seperti pisau kecil, atau cakram berbentuk bintang, dikenal sebagai shuriken. Peralatan canggih ninja lainnya adalah sabit berantai yang disebut kusarigama,[2] kaginawa (jangkar bertali) untuk memanjat dinding, ashiaro untuk membuat jejak kaki palsu agar tidak terlacak saat menjalankan misi, metsubushi (cangkang telur yang diisi dengan pasir dan serbuk logam, biasanya juga kotoran tikus) yang berfungsi untuk membutakan lawan.
Pada masa remaja mereka diajari cara menggunakan senjata khusus. Melempar pisau, penyembunyian senjata, teknik tali, berenang, taktik bawah air, dan teknik menggunakan alam untuk mendapat informasai atau untuk menyembunyikan diri. Waktu mereka dihabiskan dalam ruang tertutup atau bergelantungan di pohon untuk membangun kesabaran, daya tahan, dan stamina. Terdapat pula latihan gerak tanpa suara dan lari jarak jauh. Mereka juga diajarkan teknik melompat dari pohon ke pohon atau atap ke atap.
Pada masa akhir remaja ninja belajar menjadi aktor dan psikologi melalui tingkah laku mereka sendiri dan orang-orang di sekitarnya. Mereka mulai mengerti cara bekerja jiwa manusia, menggunakan kelemahan orang lain untuk keuntungan mereka. Mereka juga belajar membuat obat-obatan, mendapatkan jalan masuk rahasia ke dalam sebuah bangunan, cara memanjat dinding, melewati atap, mencuri di bawah rantai, mengikat musuh, cara kabur, dan menggambar peta, rute, petunjuk jalan, serta wajah.
Ninja tidak memiliki status mulia seperti samurai, sehingga ninja bebas melakukan apapun untuk mengatasi masalah tanpa terikat oleh nama baik keluarga dan kehormatan.
 Tahap
cakra Naruto adalah sangat tinggi karena Kyubi. Ebisu pernah menyatakan
bahwa daya pengawalan cakra Naruto adalah lemah karena sebagian dari
cakranya digunakan untuk membendung cakra Kyubi yang terlalu kuat (cakra
Kyubi yang luar biasa ini boleh membahayakan Naruto jika dibebaskan
dengan terlalu banyak). Kakashi pula mengatakan bahwa kekuatan kyubi
lebih kuat dari kekuatan Naruto sendiri. Maka, Naruto amat sesuai
mengendalikan jurus yang memerlukan banyak cakra seperti ‘Teknik
Pengagihan Bayang’ (Kage Bunshin no Jutsu). Ninja lain dapat
menghasilkan beberapa klon saja dengan sempurna karena jurus ini
menghendaki penggunanya membagikan cakranya dengan tepat kepada
klon-klon yang dihasilkan, berlainan pula dengan Naruto yang mampu
menghasilkan 2000 klon dan pada masa yang sama, membekalkan sejumlah
cakra yang mencukupi kepada setiap klon.
Tahap
cakra Naruto adalah sangat tinggi karena Kyubi. Ebisu pernah menyatakan
bahwa daya pengawalan cakra Naruto adalah lemah karena sebagian dari
cakranya digunakan untuk membendung cakra Kyubi yang terlalu kuat (cakra
Kyubi yang luar biasa ini boleh membahayakan Naruto jika dibebaskan
dengan terlalu banyak). Kakashi pula mengatakan bahwa kekuatan kyubi
lebih kuat dari kekuatan Naruto sendiri. Maka, Naruto amat sesuai
mengendalikan jurus yang memerlukan banyak cakra seperti ‘Teknik
Pengagihan Bayang’ (Kage Bunshin no Jutsu). Ninja lain dapat
menghasilkan beberapa klon saja dengan sempurna karena jurus ini
menghendaki penggunanya membagikan cakranya dengan tepat kepada
klon-klon yang dihasilkan, berlainan pula dengan Naruto yang mampu
menghasilkan 2000 klon dan pada masa yang sama, membekalkan sejumlah
cakra yang mencukupi kepada setiap klon.
 Cakra
Kyubi adalah jauh lebih kuat dan bahaya daripada chakra manusia biasa.
Apabila Naruto menggunakan cakra Kyubi, tubuh asalnya menjadi kian
lemah. Pada peringkat ‘empat ekor’, cakra Kyubi terlalu hebat sehingga
mampu membakar kulit Naruto menyebabkan darah mengalir dari tiap liang
roma. Sementara itu, cakra Kyubi sentiasa memulihkan semua badan rusak
Naruto. Kita dicederakan-dan-dipulihkan-semula melemahkan Naruto dan
secara alamiah memendekkan jangka hidup Naruto. Wah sedih banget yah,
kasihan banget si Naruto. Ada teman-teman yang minta kisah Naruto dan
inilah dia, semoga kalian puas. Bersumber dari Wikipedia dan pengalaman
saiya sendiri. Tingkiu…!
Cakra
Kyubi adalah jauh lebih kuat dan bahaya daripada chakra manusia biasa.
Apabila Naruto menggunakan cakra Kyubi, tubuh asalnya menjadi kian
lemah. Pada peringkat ‘empat ekor’, cakra Kyubi terlalu hebat sehingga
mampu membakar kulit Naruto menyebabkan darah mengalir dari tiap liang
roma. Sementara itu, cakra Kyubi sentiasa memulihkan semua badan rusak
Naruto. Kita dicederakan-dan-dipulihkan-semula melemahkan Naruto dan
secara alamiah memendekkan jangka hidup Naruto. Wah sedih banget yah,
kasihan banget si Naruto. Ada teman-teman yang minta kisah Naruto dan
inilah dia, semoga kalian puas. Bersumber dari Wikipedia dan pengalaman
saiya sendiri. Tingkiu…!
Daftar isi |
Definisi

Kata "ninja" dalam aksara Kanji.
Ninja juga bisa diartikan sebagai nama yang diberikan kepada seseorang yang menguasai dan mendalami seni bela diri ninjutsu. Nin artinya pertahanan dan jutsu adalah seni atau cara. Kata ninja juga diambil dari kata ninpo. Po artinya adalah falsafah hidup atau dengan kata lain ninpo adalah falsafah tertinggi dari ilmu beladiri ninjutsu yang menjadi dasar kehidupan seorang ninja. Jadi ninja akan selalu waspada dan terintregasi pada prinsip ninpo.
Ninja adalah mata-mata profesional di zaman ketika para samurai masih memegang kekuasaan tertinggi di pemerintahan Jepang pada abad ke-12. Pada abad ke-14 pertarungan memperebutkan kekuasaan semakin memanas, informasi tentang aktivitas dan kekuatan lawan menjadi penting, dan para ninja pun semakin aktif. Para ninja dipanggil oleh daimyo untuk mengumpulkan informasi, merusak dan menghancurkan gudang persenjataan ataupun gudang makanan, serta untuk memimpin pasukan penyerbuan di malam hari. Karena itu ninja memperoleh latiham khusus. Ninja tetap aktif sampai Zaman Edo (1600-1868), dimana akhirnya kekuasaan dibenahi oleh pemerintah di Zaman Edo.
Asal-usul ninja
Kemunculan ninja pada tahun 522 berhubungan erat dengan masuknya seni nonuse ke Jepang. Seni nonuse inilah yang membuka jalan bagi lahirnya ninja.Seni nonuse atau yang biasa disebut seni bertindak diam-diam adalah suatu praktik keagamaan yang dilakukan oleh para pendeta yang pada saat itu bertugas memberikan info kepada orang-orang di pemerintahan. Sekitar tahun 645, pendeta-pendeta tersebut menyempurnakan kemampuan bela diri dan mulai menggunakan pengetahuan mereka tentang nonuse untuk melindungi diri dari intimidasi pemerintah pusat.
Pada tahun 794-1192, kehidupan masyarakat Jepang mulai berkembang dan melahirkan kelas-kelas baru berdasarkan kekayaan. Keluarga kelas ini saling bertarung satu sama lain dalam usahanya menggulingkan kekaisaran. Kebutuhan keluarga akan pembunuh dan mata-mata semakin meningkat untuk memperebutkan kekuasaan. Karena itu permintaan akan para praktisi nonuse semakin meningkat. Inilah awal kelahiran ninja. Pada abad ke-16 ninja sudah dikenal dan eksis sebagai suatu keluarga atau klan di kota Iga atau Koga. Ninja pada saat itu merupakan profesi yang berhubungan erat dengan intelijen tingkat tinggi dalam pemerintah feodal para raja di jepang. Berdasarkan hal itu, masing-masing klan memiliki tradisi mengajarkan ilmu beladiri secara rahasia dalam keluarganya saja. Ilmu beladiri yang kemudian dikenal dengan nama ninjutsu. Dalah ilmu yang diwariskan dari leluhur mereka dan atas hasil penyempurnaan seni berperang selama puluhan generasi. Menurut para ahli sejarah hal itu telah berlangsung selama lebih dari 4 abad. Ilmu itu meliputi filsafat FUDOSHIN, spionase, taktik perang komando, tenaga dalam, tenaga supranatural, dan berbagai jenis bela diri lain yang tumbuh dan berkembang menurut zaman.
Namun ada sebuah catatan sejarah yang mengatakan bahwa sekitar abad ke-9 terjadi eksodus dari Cina ke Jepang. Hal ini terjadi karena runtuhnya dinasti Tang dan adanya pergolakan politik. Sehingga banyak pengungsi yang mencari perlindungan ke jepang.sebagian dari mereka adalah jendral besar, prajurit dan biksu. Mereka menetap di provinsi Iga, di tengah pulau Honshu. Jendral tersebut antara lain Cho Gyokko, Ikai Cho Busho membawa pengetahuan mereka dan membaur dengan kebudayaan setempat. Strategi militer, filsafat kepercayaan, konsep kebudayaan, ilmu pengobatan tradisional, dan falsafah tradisional. Semuanya menyatu dengan kebiasaan setempat yang akhirnya membentuk ilmu yang bernama ninjutsu.
Bela diri ninjutsu

Diagram Bansenshukai ini berisikan ramalan dan kosmologi esoterik (onmyōdō) untuk menetapkan waktu ideal seorang ninja melakukan tindakan tertentu.
Di dalam ninpo terdapat teknik beladiri tangan kosong (taijutsu), teknik pedang (kenjutsu), teknik bahan peledak dan senjata api (kajutsu), teknik hipnotis (saimonjutsu), dan teknik ilusi(genjutsu). Pada aliran Togakure Ryu dikenal adanya latihan olah energi yang disebut Kuji Kiri. Prinsipnya adalah penggabungan antara kekuatan fisik dan mental. Penyaluran energi yang tepat dari tenaga kuji kiri dapat bersifat menghancurkan, namun di sisi lain jika digunakan untuk olah pikir dapat digunakan untuk menyelesaikan persoalan yang pelik.
Ninjutsu akan sia-sia jika ninja tidak memiliki mental dan spiritual yang kuat. Untuk itu ninja harus menguasai Kuji-in, yaitu kekuatan spiritual dan mental berdasarkan simbol yang terdapat di telapak tangan yang dipercaya menjadi saluran energi. Simbol di tangan di ambil dari praktik pada massa awal penyebaran agama Buddha. Kuji-in digunakan untuk membangun kepercayaan diri dan kekuatan seorang ninja. Kuji-in mampu meningkatkan kepekaan terhadap keadaan bahaya dan mendeteksi adanya kematian.
Dari 81 simbol yang ada, hanya 9 yang utama, yaitu rin(memberi kekuatan tubuh), hei (memberi kekuatan menyamarkan kehadiran seseorang), Toh (menyeimbangkan bagian padat dan cair pada tubuh), sha (kemampuan menyembuhkan), kai(memberi kontrol menyeluruh terhadap fungsi tubuh), jin(meningkatkan kekuatan telepati), retsu (memberi kekuatan telekinetik), zai (meningkatkan keselarasan terhadap alam), dan zen (memberi pencerahan pikiran dan pemahaman). Seorang ninja akan menjadi master sejati dengan menguasai simbol-simbol ini.
Walaupun terdapat banyak keluarga ninja di Jepang, baru sekitar tahun enam puluhan keluarga ninja baru dapat di dekati oleh orang luar. Pada tahun 1960 televisi jepang menayangkan laporan dokumentasi dan sejarah ninja. Setelah itu salah satu aliran yang dapat membuka diri dan memperkenalkan ninja ke dunia luar adalah aliran togakure-ryu dengan pewaris dari generasi ke 34, masaaki hatsumi,.yang profesi sehari-harinya adalah seorang tabib ahli penyembuhan dan pengobatan tulang. Pada tahun 1978 ninjutsu berhasil di publikasikan dan diajarkan ke amerika oleh stephen k. hayes. Sejak saat itu ninjutsu menjadi cabang beladiri yang paling banyak diminati.
Peralatan ninja

Anak panah, paku, pisau, dan cakram bintang tajam, secara kolektif dikenal sebagai shuriken, senjata rahasia ninja.
Ninja memakai baju yang menutup tubuh mereka kecuali telapak tangan dan seputar mata. Baju ninja ini disebut shinobi shozoko. shinobi shozoko memiliki 3 warna. Baju warna hitam biasanya dipakai ketika melakukan misi di malam hari dan bisa juga sebagai tanda kematian yang nyata bagi sang target. Warna putih digunakan untuk misi di hari bersalju. Warna hijau sebagai kamuflase agar mereka tidak terlihat dalam lingkungan hutan.
Shinobi shozoko memiliki banyak kantong di dalam dan luarnya. Kantong ini digunakan untuk menyimpan peralatan kecil dan senjata yang mereka butuhkan, seperti racun, shuriken, pisau, bom asap dan lain-lain. Ninja juga membawa kotak P3K kecil tradisional, yang diisi dengan cairan dan minuman. Ninja juga memakai tabi yang mirip sepatu boot. Celah yang memisahkan jempol kaki dengan jari lainnya memudahkan ninja saat memanjat tali atau dinding.
Ninja wanita atau kunoichi yang biasanya bekerja dengan menggunakan kefemininan mereka ketika melakukan pendekatan pada sang target menggunakan manipulasi kejiwaan dan perang batin sebagai senjata mereka. mereka bisa mendekati target dan membunuhnya tanpa jejak. Kunoichi memiliki misi yang berbeda dengan ninja laki-laki. Mereka lebih sering dekat dengan target, sehingga mereka juga lebih sering menggunakan senjata jarak dekat seperti metsubishi, racun, golok, tali, dan tessen. Selain itu senjata-senjata tersebut juga praktis dibawa tanpa kelihatan.
Ninja memiliki senjata dalam berbagai jenis, bentuk, dan ukuran. Senjata yang biasanya dipakai adalah katana (pedang) dan sering diletakkan di punggung.[1] Senjata lempar seperti pisau kecil, atau cakram berbentuk bintang, dikenal sebagai shuriken. Peralatan canggih ninja lainnya adalah sabit berantai yang disebut kusarigama,[2] kaginawa (jangkar bertali) untuk memanjat dinding, ashiaro untuk membuat jejak kaki palsu agar tidak terlacak saat menjalankan misi, metsubushi (cangkang telur yang diisi dengan pasir dan serbuk logam, biasanya juga kotoran tikus) yang berfungsi untuk membutakan lawan.
Pelatihan
Pada saat anak-anak ninja telah dilatih untuk waspada dan dididik dalam kerahasiaan dan tradisi ilmu mereka. Pada umur 5-6 tahun mereka diperkenalkan dengan permainan ketangkasan dan keseimbangan tubuh. Anak-anak disuruh berjalan di atas papan titian yang sangat kecil, mendaki papan yang terjal, dan melompati semak-semak yang berduri. Pada umur 9 tahun mereka dilatih untuk kelenturan otot. Anak-anak berlatih berguling dan meloncat. Setelah itu anak-anak diajarkan teknik memukul dan menendang pada target jerami yang di ikat. Setelah itu pelatihan meningkat ke seni bela diri tanpa senjata dan setelahnya dasar-dasar menggunakan pedang dan tongkat.Pada masa remaja mereka diajari cara menggunakan senjata khusus. Melempar pisau, penyembunyian senjata, teknik tali, berenang, taktik bawah air, dan teknik menggunakan alam untuk mendapat informasai atau untuk menyembunyikan diri. Waktu mereka dihabiskan dalam ruang tertutup atau bergelantungan di pohon untuk membangun kesabaran, daya tahan, dan stamina. Terdapat pula latihan gerak tanpa suara dan lari jarak jauh. Mereka juga diajarkan teknik melompat dari pohon ke pohon atau atap ke atap.
Pada masa akhir remaja ninja belajar menjadi aktor dan psikologi melalui tingkah laku mereka sendiri dan orang-orang di sekitarnya. Mereka mulai mengerti cara bekerja jiwa manusia, menggunakan kelemahan orang lain untuk keuntungan mereka. Mereka juga belajar membuat obat-obatan, mendapatkan jalan masuk rahasia ke dalam sebuah bangunan, cara memanjat dinding, melewati atap, mencuri di bawah rantai, mengikat musuh, cara kabur, dan menggambar peta, rute, petunjuk jalan, serta wajah.
Filosofi ninja
Filosofi ninja adalah meraih hasil maksimal dengan tenaga minimum. Muslihat dan taktik lebih sering dilakukan daripada konfrontasi langsung.Ninja tidak memiliki status mulia seperti samurai, sehingga ninja bebas melakukan apapun untuk mengatasi masalah tanpa terikat oleh nama baik keluarga dan kehormatan.
Lihat pula
Bagi
teman-teman yang juga suka banget ama Naruto, nih aku ada kisah Naruto
dan biografi hidupnya. Naruto dilahirkan pada 10 Oktober, tahunnya tidak
diketahui. Asal usul ibu bapak dan saudaranya yang lain masih merupakan
misteri. Sejak dilahirkan lagi, syaitan musang berekor sembilan, Kyubi no Yoko yang cuba membinasakan Konoha dikurung
dalam badan Naruto oleh AYAHNYA HOKAGE KE EMPAT. Ayah Naruto Namikaze
Minato merupakan Hokage generasi keempat manakala ibunya bernama Uzumaki
Kushina. Naruto mempunyai wajah seiras ayahnya manakala sifatnya lebih
serupa dengan ibunya yang merupakan seorang tomboy ketika kecil sebelum
menjadi wanita cantik ketika dewasa.
berekor sembilan, Kyubi no Yoko yang cuba membinasakan Konoha dikurung
dalam badan Naruto oleh AYAHNYA HOKAGE KE EMPAT. Ayah Naruto Namikaze
Minato merupakan Hokage generasi keempat manakala ibunya bernama Uzumaki
Kushina. Naruto mempunyai wajah seiras ayahnya manakala sifatnya lebih
serupa dengan ibunya yang merupakan seorang tomboy ketika kecil sebelum
menjadi wanita cantik ketika dewasa.

Hokage Keempat berhajat agar orang kampung melihat Naruto sebagai seorang wira yang terpaksa memendam Kyubi. Malangnya, seluruh warga kampung menaruh kebencian dan kemarahan yang marak terhadap si kecil Naruto karena Kyubi pernah mengacaukan ketenangan
Konoha. Malah Naruto sendiri tidak mengetahui kewujudan makhluk
tersebut dalam dirinya sehingga dia mencecah usia dua belas tahun.
ketenangan
Konoha. Malah Naruto sendiri tidak mengetahui kewujudan makhluk
tersebut dalam dirinya sehingga dia mencecah usia dua belas tahun.
Uzumaki Kushina, adalah ibu Naruto.
 berekor sembilan, Kyubi no Yoko yang cuba membinasakan Konoha dikurung
dalam badan Naruto oleh AYAHNYA HOKAGE KE EMPAT. Ayah Naruto Namikaze
Minato merupakan Hokage generasi keempat manakala ibunya bernama Uzumaki
Kushina. Naruto mempunyai wajah seiras ayahnya manakala sifatnya lebih
serupa dengan ibunya yang merupakan seorang tomboy ketika kecil sebelum
menjadi wanita cantik ketika dewasa.
berekor sembilan, Kyubi no Yoko yang cuba membinasakan Konoha dikurung
dalam badan Naruto oleh AYAHNYA HOKAGE KE EMPAT. Ayah Naruto Namikaze
Minato merupakan Hokage generasi keempat manakala ibunya bernama Uzumaki
Kushina. Naruto mempunyai wajah seiras ayahnya manakala sifatnya lebih
serupa dengan ibunya yang merupakan seorang tomboy ketika kecil sebelum
menjadi wanita cantik ketika dewasa.

Hokage Keempat berhajat agar orang kampung melihat Naruto sebagai seorang wira yang terpaksa memendam Kyubi. Malangnya, seluruh warga kampung menaruh kebencian dan kemarahan yang marak terhadap si kecil Naruto karena Kyubi pernah mengacaukan
 ketenangan
Konoha. Malah Naruto sendiri tidak mengetahui kewujudan makhluk
tersebut dalam dirinya sehingga dia mencecah usia dua belas tahun.
ketenangan
Konoha. Malah Naruto sendiri tidak mengetahui kewujudan makhluk
tersebut dalam dirinya sehingga dia mencecah usia dua belas tahun.Uzumaki Kushina, adalah ibu Naruto.
Mujurlah
Naruto berpeluang mengenali seorang guru yang penyayang lagi
berdedikasi di akademi yaitu seorang ninja Chunin, Umino Iruka. Walaupun
orang tua Iruka mati dalam tangan Kyubi, Iruka tidak menyalahkan
Naruto. Iruka menerima Naruto dan bersimpati terhadap niat Naruto untuk
dikenali oleh orang kampung. Iruka mungkin merupakan orang pertama yang
benar-benar mempercayai Naruto dan meninggalkan impak besar terhadapnya.
Naruto akhirnya berjaya mengatasi perasaan sedih dan sunyi kerana
kehadiran Iruka sebagai pengganti ibu bapaknya.
Sebelum
tamat pengajian di Akademi, Naruto telah lama mengimpikan dirinya
dikenali dan diterima orang banyak. Dia akan bermain dan bergurau di
seluruh kampungnya untuk menarik perhatian. Pernah juga Naruto
menconteng grafiti pada muka monumen Hokage dengan cat dan merupakan
dirinya sebagai gadis seksi yang tidak berpakaian untuk menimbulkan
kemarahan guru-guru. Naruto juga memaklumkan kepada mereka yang
memandang rendah terhadapnya bahwa dia akan menjadi Hokage suatu masa
nanti. Setelah tamat pengajian, Naruto akhirnya dicam sebagai “Ninja
Bising, Mustahil untuk Dijangka dan Hiperaktif Nomor Satu” di Konoha
oleh Hatake Kakashi.
Sikap gigih dan tidak mudah mengalah menyebabkan Naruto berjaya mempengaruhi watak-watak lain di sekelilingnya. Pada mulanya, Naruto bersahabat dengan Konohamaru, cucu Hokage Ketiga. Konohamaru akhirnya memahami bahwa yang bulat tak datang bergolek, yang pipih tak datang melayang dan sesungguhnya usaha itu tangga kejayaan. Walaupun tampak dekil dan sedikit bodoh, Naruto boleh mengalahkan pihak lawan melalui semangat yang kental, teknik mengalih perhatian lawan yang bijak dan nasib baik semata-mata.

Sikap gigih dan tidak mudah mengalah menyebabkan Naruto berjaya mempengaruhi watak-watak lain di sekelilingnya. Pada mulanya, Naruto bersahabat dengan Konohamaru, cucu Hokage Ketiga. Konohamaru akhirnya memahami bahwa yang bulat tak datang bergolek, yang pipih tak datang melayang dan sesungguhnya usaha itu tangga kejayaan. Walaupun tampak dekil dan sedikit bodoh, Naruto boleh mengalahkan pihak lawan melalui semangat yang kental, teknik mengalih perhatian lawan yang bijak dan nasib baik semata-mata.
Naruto
suka bergurau walaupun kadang kala gurauannya mengandungi elemen yang
tak lucu. Biasanya, Naruto sering ketawa dan senyum (pada sesetengah
ketika, Naruto senyum untuk menyembunyikan masalahnya; hanya mereka yang
benar-benar rapat dengannya boleh mengetahui perasaan sebenarnya
Naruto). Dari segi luaranya, Naruto hanyalah seorang budak yang tidak
menonjol, bising, panas baran, mempunyai jiwa kental dan selalu terlibat
dalam masalah.
Salah
satu dari pada hobi Naruto ialah berkebun walaupun Naruto tidak dapat
membesarkan herbal dari rumpai (disiarkan dalam episode 20). Naruto juga
menghadiahi Kakashi Mr. Ukki, tumbuhan pasu yang boleh dilihat di tepi
tingkap Kakashi.
Naruto mengunakan Rasengan.
Naruto
juga menjadi matang dengan cepat sejajar dengan perkembangan cerita
tetapi masih kebudak-budakan dari segi pemilihan aksesori. Pakaian
tidurnya selalu diiringi dengan topi malam yang dihiasi sepasang mata
dan gigi. uangnya disimpan di dalam dompet hijau berupa katak yang
dipanggil Gama-chan.
Naruto
suka makan dan mempunyai selera seperti Akimichi Choji. Makanan
kegemaran Naruto, ramen seolah-olah bertindak sebagai penghubung antara
Naruto dengan siapa yang sudi membayar bil nanti. Dalam banyak episode,
dilihat Naruto boleh menghabiskan beberapa mangkuk aneka rasa ramen.

Musang Berekor Sembilan.

Musang Berekor Sembilan.
Sebagai
perumah bagi setan serigala, Kyubi, tubuh dan minda Naruto kadang kala
dipengaruh olehnya. Secara fisik, Naruto mempunyai sedikit ciri-ciri
Kyubi seperti tanda di pipinya. Matanya juga sipit seperti serigala.
Naruto memiliki stamina dan daya pemulihan yang tinggi yang membolehkan
Naruto sembuh daripada kecederaan parah dalam sehari dua dan luka kecil
dalam beberapa saat. Memandangkan Kyubi telah dikurung dalam Naruto
sejak bayi, adalah tidak diketahui sejauh mana personaliti Naruto
dipengaruhi oleh Kyubi. Namun, terdapat kemungkinan bahwa Kyubi
menyebabkan Naruto sangat nakal dan suka membuat kesal orang lain untuk
mendapat perhatian dan untuk tidak mengaku kalah dalam setiap
pertarungan.
 Tahap
cakra Naruto adalah sangat tinggi karena Kyubi. Ebisu pernah menyatakan
bahwa daya pengawalan cakra Naruto adalah lemah karena sebagian dari
cakranya digunakan untuk membendung cakra Kyubi yang terlalu kuat (cakra
Kyubi yang luar biasa ini boleh membahayakan Naruto jika dibebaskan
dengan terlalu banyak). Kakashi pula mengatakan bahwa kekuatan kyubi
lebih kuat dari kekuatan Naruto sendiri. Maka, Naruto amat sesuai
mengendalikan jurus yang memerlukan banyak cakra seperti ‘Teknik
Pengagihan Bayang’ (Kage Bunshin no Jutsu). Ninja lain dapat
menghasilkan beberapa klon saja dengan sempurna karena jurus ini
menghendaki penggunanya membagikan cakranya dengan tepat kepada
klon-klon yang dihasilkan, berlainan pula dengan Naruto yang mampu
menghasilkan 2000 klon dan pada masa yang sama, membekalkan sejumlah
cakra yang mencukupi kepada setiap klon.
Tahap
cakra Naruto adalah sangat tinggi karena Kyubi. Ebisu pernah menyatakan
bahwa daya pengawalan cakra Naruto adalah lemah karena sebagian dari
cakranya digunakan untuk membendung cakra Kyubi yang terlalu kuat (cakra
Kyubi yang luar biasa ini boleh membahayakan Naruto jika dibebaskan
dengan terlalu banyak). Kakashi pula mengatakan bahwa kekuatan kyubi
lebih kuat dari kekuatan Naruto sendiri. Maka, Naruto amat sesuai
mengendalikan jurus yang memerlukan banyak cakra seperti ‘Teknik
Pengagihan Bayang’ (Kage Bunshin no Jutsu). Ninja lain dapat
menghasilkan beberapa klon saja dengan sempurna karena jurus ini
menghendaki penggunanya membagikan cakranya dengan tepat kepada
klon-klon yang dihasilkan, berlainan pula dengan Naruto yang mampu
menghasilkan 2000 klon dan pada masa yang sama, membekalkan sejumlah
cakra yang mencukupi kepada setiap klon.
Cakra
Kyubi selalu menjadi lebih nyata apabila Naruto menghadapi saat-saat
genting untuk memastikan Naruto (dan juga Kyubi sendiri) dapat terus
hidup. Kemudian nanti, Naruto berupaya menghubungi Kyubi dan meminta
cakranya. Hal ini karena Kyubi dikurung dalam badan Naruto, cakranya
masih boleh mengalir keluar untuk bersatu dengan cakra Naruto. Tambahan
pula, kekuatan cakra Kyubi yang hampir dalam menyebabkan Kyubi merupakan
senjata terunggul bagi Naruto dalam pertempuran yang sengit. Apabila
Naruto menggunakan cakra Kyubi, ketangkasan dan kekuatannya meningkat
secara mendadak. Kadang kecederaannya pulih turut meningkat. Oleh sebab
staminanya berlipat ganda, Naruto boleh terus melawan tanpa merasa
letih. Naruto biasanya boleh memendamkan cakra Kyubi sebelum
transformasi ekor berlaku. Seandainya hal itu terjadi, cakra Kyubi akan
menjadi lebih nyata dengan masa. Beberapa boleh dilakukan untuk
memendamkan semua cakra Kyubi seperti jampi pengurung Jiraiya atau
teknik mengurung Yamato.
Apabila
Naruto mula-mula menggunakan cakra Kyubi, Naruto belum mampu
mengawalnya menyebabkan kemarahan di dalamnya menguasai minda Naruto.
Lama kelamaan, Naruto berupaya mengatasi masalah tersebut. Tetapi, jika
emosinya terganggu, Naruto mungkin akan menggunakan lebih banyak cakra
menyebabkan Kyubi menguasainya dirinya semula.

Naruto menewaskan Kabuto dengan jurus Rasengan.

Naruto menewaskan Kabuto dengan jurus Rasengan.
Naruto
menjadi lebih berkuasa dengan pertambahan bilangan ekor perisai cakra
Kyubi ( sebagian hanya bisa dilihat di manga japan). Sehingga ekor yang
ketiga, Naruto masih belum ada tetapi tindakannya lebih buas. Dia mula
merasakan kesakitan sebagai akibat kekuatan cakra yang terlalu besar.
Apabila Naruto mencapai tahap ‘empat ekor’, Kyubi mendominasi. Kekuatan
Naruto bercampur dengan kekuatan Kyubi. Bagi orang lain yang menyaksikan
perubahan ini, Naruto kelihatan seperti mini-Kyubi.
 Cakra
Kyubi adalah jauh lebih kuat dan bahaya daripada chakra manusia biasa.
Apabila Naruto menggunakan cakra Kyubi, tubuh asalnya menjadi kian
lemah. Pada peringkat ‘empat ekor’, cakra Kyubi terlalu hebat sehingga
mampu membakar kulit Naruto menyebabkan darah mengalir dari tiap liang
roma. Sementara itu, cakra Kyubi sentiasa memulihkan semua badan rusak
Naruto. Kita dicederakan-dan-dipulihkan-semula melemahkan Naruto dan
secara alamiah memendekkan jangka hidup Naruto. Wah sedih banget yah,
kasihan banget si Naruto. Ada teman-teman yang minta kisah Naruto dan
inilah dia, semoga kalian puas. Bersumber dari Wikipedia dan pengalaman
saiya sendiri. Tingkiu…!
Cakra
Kyubi adalah jauh lebih kuat dan bahaya daripada chakra manusia biasa.
Apabila Naruto menggunakan cakra Kyubi, tubuh asalnya menjadi kian
lemah. Pada peringkat ‘empat ekor’, cakra Kyubi terlalu hebat sehingga
mampu membakar kulit Naruto menyebabkan darah mengalir dari tiap liang
roma. Sementara itu, cakra Kyubi sentiasa memulihkan semua badan rusak
Naruto. Kita dicederakan-dan-dipulihkan-semula melemahkan Naruto dan
secara alamiah memendekkan jangka hidup Naruto. Wah sedih banget yah,
kasihan banget si Naruto. Ada teman-teman yang minta kisah Naruto dan
inilah dia, semoga kalian puas. Bersumber dari Wikipedia dan pengalaman
saiya sendiri. Tingkiu…!proses terjadinya hujan
Terjadinya Hujan
· In Alam & Lingkungan

IlmuPengetahuan.org – Air merupakan sumber daya alam yang sangat penting vital bagi kelangsungan dan perkembangan makhluk hidup di Bumi. Terjadinya hujan sangat dipengaruhi oleh konveksi di atmosfer bumi dan lautan. Konveksi
adalah proses pemindahan panas oleh gerak massa suatu fluida dari suatu
daerah ke daerah lainnya. Air-air yang terdiri dari air laut, air
sungai, air limbah, dan sebagainya tersebut umumnya mengalami proses
penguapan atau evaporasi akibat adanya bantuan dari panas sinar
matahari. Air tersebut kemudian menjadi uap melayang ke udara dan
akhirnya terus bergerak menuju langit yang tinggi bersama uap-uap air
yang lain.
Sesampai di atas, uap-uap mengalami proses pemadatan atau biasa disebut juga kondensasi
sehingga terbentuklah awan. Akibat terbawa angin yang bergerak,
awan-awan tersebut saling bertemu dan membesar dan kemudian menuju ke
atmosfir bumi yang suhunya lebih rendah atau dingin dan akhirnya
membentuk butiran es dan air. Karena terlalu berat dan tidak mampu lagi
ditopang angin akhirnya butiran-butiran air atau es tersebut jatuh ke
permukaan bumi, proses ini disebut juga proses presipitasi.
Karena semakin rendah, mengakibatkan suhu semakin naik maka es/salju
akan mencair, namun jika suhunya sangat rendah, maka akan turun tetap
menjadi salju.
Hujan Buatan
Hujan buatan merupakan
inovasi terbaru yang berguna agar proses jatuhnya hujan semakin banyak
dan cepat. Agar hujan buatan bisa terbentuk, maka dibutuhkan awan-awan
yang memiliki kadar air yang banyak dan kecepatan angin yang lambat.
Apakah hanya itu saja yang dibutuhkan? Tidak hanya itu, masih banyak
lagi yang harus dibutuhkan. Hujan buatan ini dibuat dengan cara menyemai
awan dengan menggunakan bahan yang bersifat higroskopik
sehingga proses pertumbuhan butir-butir hujan di dalam awan akan
meningkat dan selanjutnya akan mempercepat terjadinya hujan. Jenis awan Cumulus
adalah jenis awan yang sangat bagus untuk digunakan sebagai media
membuat hujan buatan. Setelah lokasi pemilihan awan-awan yang masuk
dalam kriteria ditemukan, langkah selanjutnya adalah proses penyemaian.
Proses ini membutuhkan media pesawat yang berfungsi untuk mengangkut
bubuk-bubuk yang sudah disiapkan untuk disebar di awan-awan tersebut.

Bubuk khusus tersebut terdiri dari glasiogenik berupa Perak Iodida yang berfungsi untuk membentuk es. Di dalam bubuk tersebut, dicampur pula garam dapur atau Natrium Chlorida
dan urea, bahan-bahan tersebut digunakan karena seperti kandungan yang
terdapat di awan. Untuk dapat membentuk hujan yang lebat, biasanya
dibutuhkan bubuk khusus yang sudah diterangkan di atas sebanyak 3 ton
yang disemai menggunakan pesawat terbang ke awan Cumulus selama 30 hari.
Proses pembuatan hujan buatan ini juga belum mesti berhasil. Yang
terpenting adalah penyebaran bibit hujan harus memperhatikan arah angin,
kelembaban dan tekanan udara.
Manfaat Hujan Buatan
Hujan buatan bermanfaat untuk membantu
daerah yang sedang mengalami kekeringan, pengisian waduk, keperluan air
bersih, irigasi, dan sebagainya. Karena hujan buatan ini merupakan
teknologi modifikasi cuaca, maka hujan buatan bisa terjadi kapan saja
tanpa harus menunggu musim hujan.
ATOM
Dalam materi pelajaran unsur, senyawa dan campuran berkaitan dengan atom. Untuk menambah wawasan siswa berikut dijelaskan tentang beberapa teori atom. Pada jaman dahulu ahli filsafat dari Yunani dan India kuno berpendapat di alam ada empat unsur yaitu air, tanah, udara, dan api. namun gagasan ini sudah lama ditinggalkan karena sudah tidak sesuai lagi. Aristoteles( 4 S.M.) menyatakan bahwa “setiap benda dapat dibelah menjadi bagian yang lebih kecil terus-menerus sampai tak terhingga”.
Nama “atom” berasal dari bahasa Yunani yaitu “atomos” diperkenalkan oleh Democritus(4-5 S.M.) yang artinya tidak dapat dibagi lagi atau bagain terkecil dari materi yang tidak dapat dibagi lagi.
1. Teori Atom John Dalton
Pada tahun 1803, John Dalton mengemukakan mengemukakan pendapatnaya tentang atom. Teori atom Dalton didasarkan pada dua hukum, yaitu hukum kekekalan massa (hukum Lavoisier) dan hukum susunan tetap (hukum prouts). Lavosier mennyatakan bahwa “Massa total zat-zat sebelum reaksi akan selalu sama dengan massa total zat-zat hasil reaksi”. Sedangkan Prouts menyatakan bahwa “Perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap”. Dari kedua hukum tersebut Dalton mengemukakan pendapatnya tentang atom sebagai berikut:
1. Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi
2. Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda
3. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen
4. Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Kelemahan Teori Dalton adalah tidak menerangkan hubungan antara larutan senyawa dan daya hantar arus listrik.
2. Teori Atom J. J. Thomson
Berdasarkan penemuan tabung katode yang lebih baik oleh William Crookers, maka J.J. Thomson meneliti lebih lanjut tentang sinar katode dan dapat dipastikan bahwa sinar katode merupakan partikel, sebab dapat memutar baling-baling yang diletakkan diantara katode dan anode. Dari hasil percobaan ini, Thomson menyatakan bahwa sinar katode merupakan partikel penyusun atom (partikel subatom) yang bermuatan negative dan selanjutnya disebut elektron.
Atom merupakan partikel yang bersifat netral, oleh karena elektron bermuatan negatif, maka harus ada partikel lain yang bermuatan positifuntuk menetrallkan muatan negatif elektron tersebut. Dari penemuannya tersebut, Thomson memperbaiki kelemahan dari teori atom dalton dan mengemukakan teori atomnya yang dikenal sebagai Teori Atom Thomson. Yang menyatakan bahwa:
“Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron”
Model atomini dapat digambarkan sebagai jambu biji yang sudah dikelupas kulitnya. biji jambu menggambarkan elektron yang tersebar marata dalam bola daging jambu yang pejal, yang pada model atom Thomson dianalogikan sebagai bola positif yang pejal. Model atom Thomson dapat digambarkan sebagai berikut:
Kelemahan model atom yang dikembangkan oleh Thomson ini, yaitu tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
3. Teori Atom Rutherford
Rutherford bersama dua orang muridnya (Hans Geigerdan Erners Masreden) melakukan percobaan yang dikenal dengan hamburan sinar alfa (λ) terhadap lempeng tipis emas(logam murni pada waktu itu). Sebelumya telah ditemukan adanya partikel alfa, yaitu partikel yang bermuatan positif dan bergerak lurus, berdaya tembus besar sehingga dapat menembus lembaran tipis kertas. Percobaan tersebut sebenarnya bertujuan untuk menguji pendapat Thomson, yakni apakah atom itu betul-betul merupakan bola pejal yang positif yang bila dikenai partikel alfa akan dipantulkan atau dibelokkan. Dari pengamatan mereka, didapatkan fakta bahwa apabila partikel alfa ditembakkan pada lempeng emas yang sangat tipis, maka sebagian besar partikel alfa diteruskan (ada penyimpangan sudut kurang dari 1°), tetapi dari pengamatan Marsden diperoleh fakta bahwa satu diantara 20.000 partikel alfa akan membelok sudut 90° bahkan lebih.
Berdasarkan gejala-gejala yang terjadi, diperoleh beberapa kesipulan beberapa berikut:
1. Atom bukan merupakan bola pejal, karena hampir semua partikel alfa diteruskan
2. Jika lempeng emas tersebut dianggap sebagai satu lapisanatom-atom emas, maka didalam atom emas terdapat partikel yang sangat kecil yang bermuatan positif.
3. Partikel tersebut merupakan partikelyang menyusun suatu inti atom, berdasarkan fakta bahwa 1 dari 20.000 partikel alfa akan dibelokkan. Bila perbandingan 1:20.000 merupakan perbandingan diameter, maka didapatkan ukuran inti atom kira-kira 10.000 lebih kecil daripada ukuran atom keseluruhan.
Berdasarkan fakta-fakta yang didapatkan dari percobaan tersebut, Rutherford mengusulkan model atom yang dikenal dengan Model Atom Rutherford yang menyatakan bahwa Atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif. Rutherford menduga bahwa didalam inti atom terdapat partikel netral yang berfungsi mengikat partikel-partikel positif agar tidak saling tolak menolak.
Kelemahan teori yang dijelaskan oleh Rutherford, yaitu : Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom.
4. Teori Atom Bohr
Ada tahun 1913, pakar fisika Denmark bernama Neils Bohr memperbaiki kegagalan atom Rutherford melalui percobaannya tentang spektrum atom hidrogen. Percobaannya ini berhasil memberikan gambaran keadaan elektron dalam menempati daerah disekitar inti atom. Penjelasan Bohr tentang atom hidrogen melibatkan gabungan antara teori klasik dari Rutherford dan teori kuantum dari Planck, diungkapkan dengan empat postulat, sebagai berikut:
1. Hanya ada seperangkat orbit tertentu yang diperbolehkan bagi satu elektron dalam atom hidrogen. Orbit ini dikenal sebagai keadaan gerak stasioner (menetap) elektron dan merupakan lintasan melingkar disekeliling inti.
2. Selama elektron berada dalam lintasan stasioner, energi elektron tetap sehingga tidak ada energi dalam bentuk radiasi yang dipancarkan maupun diserap.
3. Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain. Pada peralihan ini, sejumlah energi tertentu terlibat, besarnya sesuai dengan persamaan planck, ΔE = hv.
4. Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut. Besarnya momentum sudut merupakan kelipatan dari h/2∏ atau nh/2∏, dengan n adalah bilangan bulat dan h tetapan planck.
Menurut model atom bohr, elektron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi. Tingkat energi paling rendah adalah kulit elektron yang terletak paling dalam, semakin keluar semakin besar nomor kulitnya dan semakin tinggi tingkat energinya.
Kelemahan: dari penjelasan Model atom ini tidak bisa menjelaskan spektrum warna dari atom berelektron banyak.
5. Teori Atom Modern
Model atom mekanika kuantum dikembangkan oleh Erwin Schrodinger (1926).Sebelum Erwin Schrodinger, seorang ahli dari Jerman Werner Heisenberg mengembangkan teori mekanika kuantum yang dikenal dengan prinsip ketidakpastian yaitu “Tidak mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan, yang dapat ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom”.
Daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron disebut orbital. Bentuk dan tingkat energi orbital dirumuskan oleh Erwin Schrodinger.Erwin Schrodinger memecahkan suatu persamaan untuk mendapatkan fungsi gelombang untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi.
Model atom dengan orbital lintasan elektron ini disebut model atom modern atau model atom mekanika kuantum yang berlaku sampai saat ini
Ciri khas model atom mekanika gelombang
1. Gerakan elektron memiliki sifat gelombang, sehingga lintasannya (orbitnya) tidak stasioner seperti model Bohr, tetapi mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga dimensi darikebolehjadian paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom)
2. Bentuk dan ukuran orbital berg
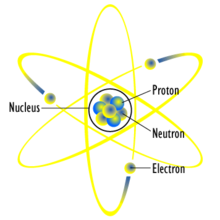
The atom is a basic unit of matter that consists of a dense central nucleus surrounded by a cloud of negatively charged electrons. The atomic nucleus contains a mix of positively charged protons and electrically neutral neutrons (except in the case of hydrogen-1, which is the only stable nuclide with no neutrons). The electrons of an atom are bound to the nucleus by the electromagnetic force. Likewise, a group of atoms can remain bound to each other by chemical bonds based on the same force, forming a molecule.
An atom containing an equal number of protons and electrons is
electrically neutral, otherwise it is positively or negatively charged
and is known as an ion. An atom is classified according to the number of protons and neutrons in its nucleus: the number of protons determines the chemical element, and the number of neutrons determines the isotope of the element.[1]
The name atom comes from the Greek ἄτομος (atomos, "indivisible") from ἀ- (a-, "not") and τέμνω (temnō, "I cut"),[2] which means uncuttable, or indivisible, something that cannot be divided further.[3] The concept of an atom as an indivisible component of matter was first proposed by early Indian and Greek philosophers. In the 18th and 19th centuries, chemists provided a physical basis for this idea by showing that certain substances could not be further broken down by chemical methods, and they applied the ancient philosophical name of atom to the chemical entity. During the late 19th and early 20th centuries, physicists discovered subatomic components and structure inside the atom, thereby demonstrating that the chemical "atom" was divisible and that the name might not be appropriate.[4][5]. However, it was retained. This has led to some debate about whether the ancient philosophers, who intended to refer to fundamental individual objects with their concept of "atoms," were referring to modern chemical atoms, or something more like indivisible subatomic particles such as leptons or quarks, or even some more fundamental particle that has yet to be discovered.[6]
Chemical atoms, which in science now carry the simple name of "atom," are minuscule objects with diameters of a few tenths of a nanometer and tiny masses proportional to the volume implied by these dimensions. Atoms can only be observed individually using special instruments such as the scanning tunneling microscope. Over 99.94% of an atom's mass is concentrated in the nucleus,[note 1] with protons and neutrons having roughly equal mass. Each element has at least one isotope with an unstable nucleus that can undergo radioactive decay. This can result in a transmutation that changes the number of protons or neutrons in a nucleus.[7] Electrons that are bound to atoms possess a set of stable energy levels, or orbitals, and can undergo transitions between them by absorbing or emitting photons that match the energy differences between the levels. The electrons determine the chemical properties of an element, and strongly influence an atom's magnetic properties. The principles of quantum mechanics have been successfully used to model the observed properties of the atom.
References to the concept of atoms date back to ancient Greece and India. In India, the Ājīvika, Jain, and Cārvāka schools of atomism may date back to the 6th century BCE.[9] The Nyaya and Vaisheshika schools later developed theories on how atoms combined into more complex objects.[10] In the West, the references to atoms emerged in the 5th century BCE with Leucippus, whose student, Democritus, systematized his views. In approximately 450 BCE, Democritus coined the term átomos (Greek: ἄτομος), which means "uncuttable" or "the smallest indivisible particle of matter". Although the Indian and Greek concepts of the atom were based purely on philosophy, modern science has retained the name coined by Democritus.[8]
Corpuscularianism is the postulate, expounded in the 13th-century by the alchemist Pseudo-Geber (Geber),[11] sometimes identified with Paul of Taranto, that all physical bodies possess an inner and outer layer of minute particles or corpuscles.[12] Corpuscularianism is similar to the theory of atomism, except that where atoms were supposed to be indivisible, corpuscles could in principle be divided. In this manner, for example, it was theorized that mercury could penetrate into metals and modify their inner structure.[13] Corpuscularianism stayed a dominant theory over the next several hundred years.
In 1661, natural philosopher Robert Boyle published The Sceptical Chymist in which he argued that matter was composed of various combinations of different "corpuscules" or atoms, rather than the classical elements of air, earth, fire and water.[14] During the 1670s corpuscularianism was used by Isaac Newton in his development of the corpuscular theory of light.[12][15]
 Further progress in the understanding of atoms did not occur until the science of chemistry began to develop. In 1789, French nobleman and scientific researcher Antoine Lavoisier discovered the law of conservation of mass and defined an element as a basic substance that could not be further broken down by the methods of chemistry.[16]
Further progress in the understanding of atoms did not occur until the science of chemistry began to develop. In 1789, French nobleman and scientific researcher Antoine Lavoisier discovered the law of conservation of mass and defined an element as a basic substance that could not be further broken down by the methods of chemistry.[16]
In 1805, English instructor and natural philosopher John Dalton used the concept of atoms to explain why elements always react in ratios of small whole numbers (the law of multiple proportions) and why certain gases dissolved better in water than others. He proposed that each element consists of atoms of a single, unique type, and that these atoms can join together to form chemical compounds.[17][18] Dalton is considered the originator of modern atomic theory.[19]
Dalton's atomic hypothesis did not specify the size of atoms. Common sense indicated they must be very small, but nobody knew how small. Therefore it was a major landmark when in 1865 Johann Josef Loschmidt measured the size of the molecules that make up air.
An additional line of reasoning in support of particle theory (and by extension atomic theory) began in 1827 when botanist Robert Brown used a microscope to look at dust grains floating in water and discovered that they moved about erratically—a phenomenon that became known as "Brownian motion". J. Desaulx suggested in 1877 that the phenomenon was caused by the thermal motion of water molecules, and in 1905 Albert Einstein produced the first mathematical analysis of the motion.[20][21][22] French physicist Jean Perrin used Einstein's work to experimentally determine the mass and dimensions of atoms, thereby conclusively verifying Dalton's atomic theory.[23]
 In 1869, building upon earlier discoveries by such scientists as Lavoisier, Dmitri Mendeleev published the first functional periodic table.[24] The table itself is a visual representation of the periodic law, which states that certain chemical properties of elements repeat periodically when arranged by atomic number.[25]
In 1869, building upon earlier discoveries by such scientists as Lavoisier, Dmitri Mendeleev published the first functional periodic table.[24] The table itself is a visual representation of the periodic law, which states that certain chemical properties of elements repeat periodically when arranged by atomic number.[25]
 The physicist J. J. Thomson, through his work on cathode rays
in 1897, discovered the electron, and concluded that they were a
component of every atom. Thus he overturned the belief that atoms are
the indivisible, ultimate particles of matter.[26]
Thomson postulated that the low mass, negatively charged electrons were
distributed throughout the atom, possibly rotating in rings, with their
charge balanced by the presence of a uniform sea of positive charge.
This later became known as the plum pudding model.
The physicist J. J. Thomson, through his work on cathode rays
in 1897, discovered the electron, and concluded that they were a
component of every atom. Thus he overturned the belief that atoms are
the indivisible, ultimate particles of matter.[26]
Thomson postulated that the low mass, negatively charged electrons were
distributed throughout the atom, possibly rotating in rings, with their
charge balanced by the presence of a uniform sea of positive charge.
This later became known as the plum pudding model.
In 1909, Hans Geiger and Ernest Marsden, under the direction of physicist Ernest Rutherford, bombarded a sheet of gold foil with alpha rays—by then known to be positively charged helium atoms—and discovered that a small percentage of these particles were deflected through much larger angles than was predicted using Thomson's proposal. Rutherford interpreted the gold foil experiment as suggesting that the positive charge of a heavy gold atom and most of its mass was concentrated in a nucleus at the center of the atom—the Rutherford model.[27]
While experimenting with the products of radioactive decay, in 1913 radiochemist Frederick Soddy discovered that there appeared to be more than one type of atom at each position on the periodic table.[28] The term isotope was coined by Margaret Todd as a suitable name for different atoms that belong to the same element. J.J. Thomson created a technique for separating atom types through his work on ionized gases, which subsequently led to the discovery of stable isotopes.[29]
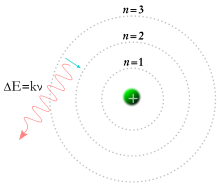 Meanwhile, in 1913, physicist Niels Bohr
suggested that the electrons were confined into clearly defined,
quantized orbits, and could jump between these, but could not freely
spiral inward or outward in intermediate states.[30] An electron must absorb or emit specific amounts of energy to transition between these fixed orbits. When the light from a heated material was passed through a prism, it produced a multi-colored spectrum. The appearance of fixed lines in this spectrum was successfully explained by these orbital transitions.[31]
Meanwhile, in 1913, physicist Niels Bohr
suggested that the electrons were confined into clearly defined,
quantized orbits, and could jump between these, but could not freely
spiral inward or outward in intermediate states.[30] An electron must absorb or emit specific amounts of energy to transition between these fixed orbits. When the light from a heated material was passed through a prism, it produced a multi-colored spectrum. The appearance of fixed lines in this spectrum was successfully explained by these orbital transitions.[31]
Later in the same year Henry Moseley provided additional experimental evidence in favor of Niels Bohr's theory. These results refined Ernest Rutherford's and Antonius Van den Broek's model, which proposed that the atom contains in its nucleus a number of positive nuclear charges that is equal to its (atomic) number in the periodic table. Until these experiments, atomic number was not known to be a physical and experimental quantity. That it is equal to the atomic nuclear charge remains the accepted atomic model today.[32]
Chemical bonds between atoms were now explained, by Gilbert Newton Lewis in 1916, as the interactions between their constituent electrons.[33] As the chemical properties of the elements were known to largely repeat themselves according to the periodic law,[34] in 1919 the American chemist Irving Langmuir suggested that this could be explained if the electrons in an atom were connected or clustered in some manner. Groups of electrons were thought to occupy a set of electron shells about the nucleus.[35]
The Stern–Gerlach experiment of 1922 provided further evidence of the quantum nature of the atom. When a beam of silver atoms was passed through a specially shaped magnetic field, the beam was split based on the direction of an atom's angular momentum, or spin. As this direction is random, the beam could be expected to spread into a line. Instead, the beam was split into two parts, depending on whether the atomic spin was oriented up or down.[36]
In 1924, Louis de Broglie proposed that all particles behave to an extent like waves. In 1926, Erwin Schrödinger used this idea to develop a mathematical model of the atom that described the electrons as three-dimensional waveforms rather than point particles. A consequence of using waveforms to describe particles is that it is mathematically impossible to obtain precise values for both the position and momentum of a particle at the same time; this became known as the uncertainty principle, formulated by Werner Heisenberg in 1926. In this concept, for a given accuracy in measuring a position one could only obtain a range of probable values for momentum, and vice versa. This model was able to explain observations of atomic behavior that previous models could not, such as certain structural and spectral patterns of atoms larger than hydrogen. Thus, the planetary model of the atom was discarded in favor of one that described atomic orbital zones around the nucleus where a given electron is most likely to be observed.[37][38]
The development of the mass spectrometer allowed the exact mass of atoms to be measured. The device uses a magnet to bend the trajectory of a beam of ions, and the amount of deflection is determined by the ratio of an atom's mass to its charge. The chemist Francis William Aston used this instrument to show that isotopes had different masses. The atomic mass of these isotopes varied by integer amounts, called the whole number rule.[39] The explanation for these different isotopes awaited the discovery of the neutron, a neutral-charged particle with a mass similar to the proton, by the physicist James Chadwick in 1932. Isotopes were then explained as elements with the same number of protons, but different numbers of neutrons within the nucleus.[40]
In the 1950s, the development of improved particle accelerators and particle detectors allowed scientists to study the impacts of atoms moving at high energies.[45] Neutrons and protons were found to be hadrons, or composites of smaller particles called quarks. The standard model of particle physics was developed that so far has successfully explained the properties of the nucleus in terms of these sub-atomic particles and the forces that govern their interactions.[46]
The electron is by far the least massive of these particles at 9.11×10−31 kg, with a negative electrical charge and a size that is too small to be measured using available techniques.[47] Protons have a positive charge and a mass 1,836 times that of the electron, at 1.6726×10−27 kg, although this can be reduced by changes to the energy binding the proton into an atom. Neutrons have no electrical charge and have a free mass of 1,839 times the mass of electrons,[48] or 1.6929×10−27 kg. Neutrons and protons have comparable dimensions—on the order of 2.5×10−15 m—although the 'surface' of these particles is not sharply defined.[49]
In the Standard Model of physics, electrons are truly elementary particles with no internal structure. However, both protons and neutrons are composite particles composed of elementary particles called quarks. There are two types of quarks in atoms, each having a fractional electric charge. Protons are composed of two up quarks (each with charge +2⁄3) and one down quark (with a charge of −1⁄3). Neutrons consist of one up quark and two down quarks. This distinction accounts for the difference in mass and charge between the two particles.[50][51]
The quarks are held together by the strong interaction (or strong force), which is mediated by gluons. The protons and neutrons, in turn, are held to each other in the nucleus by the nuclear force, which is a residuum of the strong force that has somewhat different range-properties (see the article on the nuclear force for more). The gluon is a member of the family of gauge bosons, which are elementary particles that mediate physical forces.[50][51]
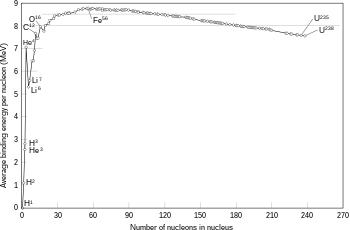 All the bound protons and neutrons in an atom make up a tiny atomic nucleus, and are collectively called nucleons. The radius of a nucleus is approximately equal to
All the bound protons and neutrons in an atom make up a tiny atomic nucleus, and are collectively called nucleons. The radius of a nucleus is approximately equal to ![\scriptstyle 1.07 \sqrt[3]{A} \text{ fm}](http://upload.wikimedia.org/math/b/9/4/b945dd398743b9af9d401ac649aa2b86.png) , where A is the total number of nucleons.[52] This is much smaller than the radius of the atom, which is on the order of 105 fm. The nucleons are bound together by a short-ranged attractive potential called the residual strong force. At distances smaller than 2.5 fm this force is much more powerful than the electrostatic force that causes positively charged protons to repel each other.[53]
, where A is the total number of nucleons.[52] This is much smaller than the radius of the atom, which is on the order of 105 fm. The nucleons are bound together by a short-ranged attractive potential called the residual strong force. At distances smaller than 2.5 fm this force is much more powerful than the electrostatic force that causes positively charged protons to repel each other.[53]
Atoms of the same element have the same number of protons, called the atomic number. Within a single element, the number of neutrons may vary, determining the isotope of that element. The total number of protons and neutrons determine the nuclide. The number of neutrons relative to the protons determines the stability of the nucleus, with certain isotopes undergoing radioactive decay.[54]
The neutron and the proton are different types of fermions. The Pauli exclusion principle is a quantum mechanical effect that prohibits identical fermions, such as multiple protons, from occupying the same quantum physical state at the same time. Thus every proton in the nucleus must occupy a different state, with its own energy level, and the same rule applies to all of the neutrons. This prohibition does not apply to a proton and neutron occupying the same quantum state.[55]
For atoms with low atomic numbers, a nucleus that has a different number of protons than neutrons can potentially drop to a lower energy state through a radioactive decay that causes the number of protons and neutrons to more closely match. As a result, atoms with roughly matching numbers of protons and neutrons are more stable against decay. However, with increasing atomic number, the mutual repulsion of the protons requires an increasing proportion of neutrons to maintain the stability of the nucleus, which modifies this trend. Thus, there are no stable nuclei with equal proton and neutron numbers above atomic number Z = 20 (calcium); and as Z increases toward the heaviest nuclei, the ratio of neutrons per proton required for stability increases to about 1.5.[55]
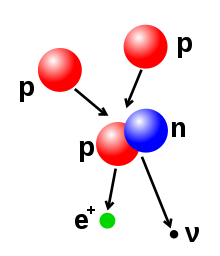 The number of protons and neutrons in the atomic nucleus can be
modified, although this can require very high energies because of the
strong force. Nuclear fusion
occurs when multiple atomic particles join to form a heavier nucleus,
such as through the energetic collision of two nuclei. For example, at
the core of the Sun protons require energies of 3–10 keV to overcome
their mutual repulsion—the coulomb barrier—and fuse together into a single nucleus.[56] Nuclear fission
is the opposite process, causing a nucleus to split into two smaller
nuclei—usually through radioactive decay. The nucleus can also be
modified through bombardment by high energy subatomic particles or
photons. If this modifies the number of protons in a nucleus, the atom
changes to a different chemical element.[57][58]
The number of protons and neutrons in the atomic nucleus can be
modified, although this can require very high energies because of the
strong force. Nuclear fusion
occurs when multiple atomic particles join to form a heavier nucleus,
such as through the energetic collision of two nuclei. For example, at
the core of the Sun protons require energies of 3–10 keV to overcome
their mutual repulsion—the coulomb barrier—and fuse together into a single nucleus.[56] Nuclear fission
is the opposite process, causing a nucleus to split into two smaller
nuclei—usually through radioactive decay. The nucleus can also be
modified through bombardment by high energy subatomic particles or
photons. If this modifies the number of protons in a nucleus, the atom
changes to a different chemical element.[57][58]
If the mass of the nucleus following a fusion reaction is less than the sum of the masses of the separate particles, then the difference between these two values can be emitted as a type of usable energy (such as a gamma ray, or the kinetic energy of a beta particle), as described by Albert Einstein's mass–energy equivalence formula, E = mc2, where m is the mass loss and c is the speed of light. This deficit is part of the binding energy of the new nucleus, and it is the non-recoverable loss of the energy that causes the fused particles to remain together in a state that requires this energy to separate.[59]
The fusion of two nuclei that create larger nuclei with lower atomic numbers than iron and nickel—a total nucleon number of about 60—is usually an exothermic process that releases more energy than is required to bring them together.[60] It is this energy-releasing process that makes nuclear fusion in stars a self-sustaining reaction. For heavier nuclei, the binding energy per nucleon in the nucleus begins to decrease. That means fusion processes producing nuclei that have atomic numbers higher than about 26, and atomic masses higher than about 60, is an endothermic process. These more massive nuclei can not undergo an energy-producing fusion reaction that can sustain the hydrostatic equilibrium of a star.[55]
 The electrons in an atom are attracted to the protons in the nucleus by the electromagnetic force. This force binds the electrons inside an electrostatic potential well
surrounding the smaller nucleus, which means that an external source of
energy is needed for the electron to escape. The closer an electron is
to the nucleus, the greater the attractive force. Hence electrons bound
near the center of the potential well require more energy to escape than
those at greater separations.
The electrons in an atom are attracted to the protons in the nucleus by the electromagnetic force. This force binds the electrons inside an electrostatic potential well
surrounding the smaller nucleus, which means that an external source of
energy is needed for the electron to escape. The closer an electron is
to the nucleus, the greater the attractive force. Hence electrons bound
near the center of the potential well require more energy to escape than
those at greater separations.
Electrons, like other particles, have properties of both a particle and a wave. The electron cloud is a region inside the potential well where each electron forms a type of three-dimensional standing wave—a wave form that does not move relative to the nucleus. This behavior is defined by an atomic orbital, a mathematical function that characterises the probability that an electron appears to be at a particular location when its position is measured.[61] Only a discrete (or quantized) set of these orbitals exist around the nucleus, as other possible wave patterns rapidly decay into a more stable form.[62] Orbitals can have one or more ring or node structures, and they differ from each other in size, shape and orientation.[63]
 Each atomic orbital corresponds to a particular energy level of the electron. The electron can change its state to a higher energy level by absorbing a photon with sufficient energy to boost it into the new quantum state. Likewise, through spontaneous emission,
an electron in a higher energy state can drop to a lower energy state
while radiating the excess energy as a photon. These characteristic
energy values, defined by the differences in the energies of the quantum
states, are responsible for atomic spectral lines.[62]
Each atomic orbital corresponds to a particular energy level of the electron. The electron can change its state to a higher energy level by absorbing a photon with sufficient energy to boost it into the new quantum state. Likewise, through spontaneous emission,
an electron in a higher energy state can drop to a lower energy state
while radiating the excess energy as a photon. These characteristic
energy values, defined by the differences in the energies of the quantum
states, are responsible for atomic spectral lines.[62]
The amount of energy needed to remove or add an electron—the electron binding energy—is far less than the binding energy of nucleons. For example, it requires only 13.6 eV to strip a ground-state electron from a hydrogen atom,[64] compared to 2.23 million eV for splitting a deuterium nucleus.[65] Atoms are electrically neutral if they have an equal number of protons and electrons. Atoms that have either a deficit or a surplus of electrons are called ions. Electrons that are farthest from the nucleus may be transferred to other nearby atoms or shared between atoms. By this mechanism, atoms are able to bond into molecules and other types of chemical compounds like ionic and covalent network crystals.[66]
About 339 nuclides occur naturally on Earth,[71] of which 253 (about 75%) have not been observed to decay, and are referred to as "stable isotopes". However, only 90 of these nuclides are stable to all decay, even in theory. Another 163 (bringing the total to 253) have not been observed to decay, even though in theory it is energetically possible. These are also formally classified as "stable". An additional 35 radioactive nuclides have half-lives longer than 80 million years, and are long-lived enough to be present from the birth of the solar system. This collection of 288 nuclides are known as primordial nuclides. Finally, an additional 51 short-lived nuclides are known to occur naturally, as daughter products of primordial nuclide decay (such as radium from uranium), or else as products of natural energetic processes on Earth, such as cosmic ray bombardment (for example, carbon-14).[72][note 2]
For 80 of the chemical elements, at least one stable isotope exists. As a rule, there is only a handful of stable isotopes for each of these elements, the average being 3.2 stable isotopes per element. Twenty-six elements have only a single stable isotope, while the largest number of stable isotopes observed for any element is ten, for the element tin. Elements 43, 61, and all elements numbered 83 or higher have no stable isotopes.[73][page needed]
Stability of isotopes is affected by the ratio of protons to neutrons, and also by the presence of certain "magic numbers" of neutrons or protons that represent closed and filled quantum shells. These quantum shells correspond to a set of energy levels within the shell model of the nucleus; filled shells, such as the filled shell of 50 protons for tin, confers unusual stability on the nuclide. Of the 253 known stable nuclides, only four have both an odd number of protons and odd number of neutrons: hydrogen-2 (deuterium), lithium-6, boron-10 and nitrogen-14. Also, only four naturally occurring, radioactive odd-odd nuclides have a half-life over a billion years: potassium-40, vanadium-50, lanthanum-138 and tantalum-180m. Most odd-odd nuclei are highly unstable with respect to beta decay, because the decay products are even-even, and are therefore more strongly bound, due to nuclear pairing effects.[73][page needed]
The actual mass of an atom at rest is often expressed using the unified atomic mass unit (u), which is also called a dalton (Da). This unit is defined as a twelfth of the mass of a free neutral atom of carbon-12, which is approximately 1.66×10−27 kg.[74] Hydrogen-1, the lightest isotope of hydrogen and the atom with the lowest mass, has an atomic weight of 1.007825 u.[75] The value of this number is called the atomic mass. A given atom has an atomic mass approximately equal (within 1%) to its mass number times the mass of the atomic mass unit. However, this number will not be an exact whole number except in the case of carbon-12 (see below)[76] The heaviest stable atom is lead-208,[69] with a mass of 207.9766521 u.[77]
As even the most massive atoms are far too light to work with directly, chemists instead use the unit of moles. One mole of atoms of any element always has the same number of atoms (about 6.022×1023). This number was chosen so that if an element has an atomic mass of 1 u, a mole of atoms of that element has a mass close to one gram. Because of the definition of the unified atomic mass unit, each carbon-12 atom has an atomic mass of exactly 12 u, and so a mole of carbon-12 atoms weighs exactly 0.012 kg.[74][page needed]
When subjected to external fields, like an electrical field, the shape of an atom may deviate from that of a sphere. The deformation depends on the field magnitude and the orbital type of outer shell electrons, as shown by group-theoretical considerations. Aspherical deviations might be elicited for instance in crystals, where large crystal-electrical fields may occur at low-symmetry lattice sites.[81] Significant ellipsoidal deformations have recently been shown to occur for sulfur ions in pyrite-type compounds.[82]
Atomic dimensions are thousands of times smaller than the wavelengths of light (400–700 nm) so they can not be viewed using an optical microscope. However, individual atoms can be observed using a scanning tunneling microscope. To visualize the minuteness of the atom, consider that a typical human hair is about 1 million carbon atoms in width.[83] A single drop of water contains about 2 sextillion (2×1021) atoms of oxygen, and twice the number of hydrogen atoms.[84] A single carat diamond with a mass of 2×10−4 kg contains about 10 sextillion (1022) atoms of carbon.[note 3] If an apple were magnified to the size of the Earth, then the atoms in the apple would be approximately the size of the original apple.[85]
 Every element has one or more isotopes that have unstable nuclei that
are subject to radioactive decay, causing the nucleus to emit particles
or electromagnetic radiation. Radioactivity can occur when the radius
of a nucleus is large compared with the radius of the strong force,
which only acts over distances on the order of 1 fm.[86]
Every element has one or more isotopes that have unstable nuclei that
are subject to radioactive decay, causing the nucleus to emit particles
or electromagnetic radiation. Radioactivity can occur when the radius
of a nucleus is large compared with the radius of the strong force,
which only acts over distances on the order of 1 fm.[86]
The most common forms of radioactive decay are:[87][88]
Each radioactive isotope has a characteristic decay time period—the half-life—that is determined by the amount of time needed for half of a sample to decay. This is an exponential decay process that steadily decreases the proportion of the remaining isotope by 50% every half-life. Hence after two half-lives have passed only 25% of the isotope is present, and so forth.[86]
The magnetic field produced by an atom—its magnetic moment—is determined by these various forms of angular momentum, just as a rotating charged object classically produces a magnetic field. However, the most dominant contribution comes from spin. Due to the nature of electrons to obey the Pauli exclusion principle, in which no two electrons may be found in the same quantum state, bound electrons pair up with each other, with one member of each pair in a spin up state and the other in the opposite, spin down state. Thus these spins cancel each other out, reducing the total magnetic dipole moment to zero in some atoms with even number of electrons.[90]
In ferromagnetic elements such as iron, an odd number of electrons leads to an unpaired electron and a net overall magnetic moment. The orbitals of neighboring atoms overlap and a lower energy state is achieved when the spins of unpaired electrons are aligned with each other, a process known as an exchange interaction. When the magnetic moments of ferromagnetic atoms are lined up, the material can produce a measurable macroscopic field. Paramagnetic materials have atoms with magnetic moments that line up in random directions when no magnetic field is present, but the magnetic moments of the individual atoms line up in the presence of a field.[90][91]
The nucleus of an atom can also have a net spin. Normally these nuclei are aligned in random directions because of thermal equilibrium. However, for certain elements (such as xenon-129) it is possible to polarize a significant proportion of the nuclear spin states so that they are aligned in the same direction—a condition called hyperpolarization. This has important applications in magnetic resonance imaging.[92][93]
For an electron to transition between two different states, it must absorb or emit a photon at an energy matching the difference in the potential energy of those levels. The energy of an emitted photon is proportional to its frequency, so these specific energy levels appear as distinct bands in the electromagnetic spectrum.[95] Each element has a characteristic spectrum that can depend on the nuclear charge, subshells filled by electrons, the electromagnetic interactions between the electrons and other factors.[96]
When a continuous spectrum of energy is passed through a gas or plasma, some of the photons are absorbed by atoms, causing electrons to change their energy level. Those excited electrons that remain bound to their atom spontaneously emit this energy as a photon, traveling in a random direction, and so drop back to lower energy levels. Thus the atoms behave like a filter that forms a series of dark absorption bands in the energy output. (An observer viewing the atoms from a view that does not include the continuous spectrum in the background, instead sees a series of emission lines from the photons emitted by the atoms.) Spectroscopic measurements of the strength and width of spectral lines allow the composition and physical properties of a substance to be determined.[97]
Close examination of the spectral lines reveals that some display a fine structure splitting. This occurs because of spin-orbit coupling, which is an interaction between the spin and motion of the outermost electron.[98] When an atom is in an external magnetic field, spectral lines become split into three or more components; a phenomenon called the Zeeman effect. This is caused by the interaction of the magnetic field with the magnetic moment of the atom and its electrons. Some atoms can have multiple electron configurations with the same energy level, which thus appear as a single spectral line. The interaction of the magnetic field with the atom shifts these electron configurations to slightly different energy levels, resulting in multiple spectral lines.[99] The presence of an external electric field can cause a comparable splitting and shifting of spectral lines by modifying the electron energy levels, a phenomenon called the Stark effect.[100]
If a bound electron is in an excited state, an interacting photon with the proper energy can cause stimulated emission of a photon with a matching energy level. For this to occur, the electron must drop to a lower energy state that has an energy difference matching the energy of the interacting photon. The emitted photon and the interacting photon then move off in parallel and with matching phases. That is, the wave patterns of the two photons are synchronized. This physical property is used to make lasers, which can emit a coherent beam of light energy in a narrow frequency band.[101]
The chemical elements are often displayed in a periodic table that is laid out to display recurring chemical properties, and elements with the same number of valence electrons form a group that is aligned in the same column of the table. (The horizontal rows correspond to the filling of a quantum shell of electrons.) The elements at the far right of the table have their outer shell completely filled with electrons, which results in chemically inert elements known as the noble gases.[104][105]
 Quantities of atoms are found in different states of matter that depend on the physical conditions, such as temperature and pressure. By varying the conditions, materials can transition between solids, liquids, gases and plasmas. [106] Within a state, a material can also exist in different phases. An example of this is solid carbon, which can exist as graphite or diamond.[107]
Quantities of atoms are found in different states of matter that depend on the physical conditions, such as temperature and pressure. By varying the conditions, materials can transition between solids, liquids, gases and plasmas. [106] Within a state, a material can also exist in different phases. An example of this is solid carbon, which can exist as graphite or diamond.[107]
At temperatures close to absolute zero, atoms can form a Bose–Einstein condensate, at which point quantum mechanical effects, which are normally only observed at the atomic scale, become apparent on a macroscopic scale.[108][109] This super-cooled collection of atoms then behaves as a single super atom, which may allow fundamental checks of quantum mechanical behavior.[110]
 The scanning tunneling microscope is a device for viewing surfaces at the atomic level. It uses the quantum tunneling
phenomenon, which allows particles to pass through a barrier that would
normally be insurmountable. Electrons tunnel through the vacuum between
two planar metal electrodes, on each of which is an adsorbed
atom, providing a tunneling-current density that can be measured.
Scanning one atom (taken as the tip) as it moves past the other (the
sample) permits plotting of tip displacement versus lateral separation
for a constant current. The calculation shows the extent to which
scanning-tunneling-microscope images of an individual atom are visible.
It confirms that for low bias, the microscope images the space-averaged
dimensions of the electron orbitals across closely packed energy
levels—the Fermi level local density of states.[111][112]
The scanning tunneling microscope is a device for viewing surfaces at the atomic level. It uses the quantum tunneling
phenomenon, which allows particles to pass through a barrier that would
normally be insurmountable. Electrons tunnel through the vacuum between
two planar metal electrodes, on each of which is an adsorbed
atom, providing a tunneling-current density that can be measured.
Scanning one atom (taken as the tip) as it moves past the other (the
sample) permits plotting of tip displacement versus lateral separation
for a constant current. The calculation shows the extent to which
scanning-tunneling-microscope images of an individual atom are visible.
It confirms that for low bias, the microscope images the space-averaged
dimensions of the electron orbitals across closely packed energy
levels—the Fermi level local density of states.[111][112]
An atom can be ionized by removing one of its electrons. The electric charge causes the trajectory of an atom to bend when it passes through a magnetic field. The radius by which the trajectory of a moving ion is turned by the magnetic field is determined by the mass of the atom. The mass spectrometer uses this principle to measure the mass-to-charge ratio of ions. If a sample contains multiple isotopes, the mass spectrometer can determine the proportion of each isotope in the sample by measuring the intensity of the different beams of ions. Techniques to vaporize atoms include inductively coupled plasma atomic emission spectroscopy and inductively coupled plasma mass spectrometry, both of which use a plasma to vaporize samples for analysis.[113]
A more area-selective method is electron energy loss spectroscopy, which measures the energy loss of an electron beam within a transmission electron microscope when it interacts with a portion of a sample. The atom-probe tomograph has sub-nanometer resolution in 3-D and can chemically identify individual atoms using time-of-flight mass spectrometry.[114]
Spectra of excited states can be used to analyze the atomic composition of distant stars. Specific light wavelengths contained in the observed light from stars can be separated out and related to the quantized transitions in free gas atoms. These colors can be replicated using a gas-discharge lamp containing the same element.[115] Helium was discovered in this way in the spectrum of the Sun 23 years before it was found on Earth.[116]
Since the Big Bang, which produced no carbon, atomic nuclei have been combined in stars through the process of nuclear fusion to produce more of the element helium, and (via the triple alpha process) the sequence of elements from carbon up to iron.[126]
Isotopes such as lithium-6, as well as some beryllium and boron are generated in space through cosmic ray spallation.[127] This occurs when a high-energy proton strikes an atomic nucleus, causing large numbers of nucleons to be ejected.
Elements heavier than iron were produced in supernovae through the r-process and in AGB stars through the s-process, both of which involve the capture of neutrons by atomic nuclei.[128] Elements such as lead formed largely through the radioactive decay of heavier elements.[129]
There are a few trace atoms on Earth that were not present at the beginning (i.e., not "primordial"), nor are results of radioactive decay. Carbon-14 is continuously generated by cosmic rays in the atmosphere.[133] Some atoms on Earth have been artificially generated either deliberately or as by-products of nuclear reactors or explosions.[134][135] Of the transuranic elements—those with atomic numbers greater than 92—only plutonium and neptunium occur naturally on Earth.[136][137] Transuranic elements have radioactive lifetimes shorter than the current age of the Earth[138] and thus identifiable quantities of these elements have long since decayed, with the exception of traces of plutonium-244 possibly deposited by cosmic dust.[130] Natural deposits of plutonium and neptunium are produced by neutron capture in uranium ore.[139]
The Earth contains approximately 1.33×1050 atoms.[140] In the planet's atmosphere, small numbers of independent atoms of noble gases exist, such as argon and neon. The remaining 99% of the atmosphere is bound in the form of molecules, including carbon dioxide and diatomic oxygen and nitrogen. At the surface of the Earth, atoms combine to form various compounds, including water, salt, silicates and oxides. Atoms can also combine to create materials that do not consist of discrete molecules, including crystals and liquid or solid metals.[141][142] This atomic matter forms networked arrangements that lack the particular type of small-scale interrupted order associated with molecular matter.[143]
Each particle of matter has a corresponding antimatter particle with the opposite electrical charge. Thus, the positron is a positively charged antielectron and the antiproton is a negatively charged equivalent of a proton. When a matter and corresponding antimatter particle meet, they annihilate each other. Because of this, along with an imbalance between the number of matter and antimatter particles, the latter are rare in the universe. (The first causes of this imbalance are not yet fully understood, although the baryogenesis theories may offer an explanation.) As a result, no antimatter atoms have been discovered in nature.[146][147] However, in 1996, antihydrogen, the antimatter counterpart of hydrogen, was synthesized at the CERN laboratory in Geneva.[148][149]
Other exotic atoms have been created by replacing one of the protons, neutrons or electrons with other particles that have the same charge. For example, an electron can be replaced by a more massive muon, forming a muonic atom. These types of atoms can be used to test the fundamental predictions of physics.[150][151][152]
Atom adalah suatu satuan dasar materi, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang mengelilinginya. Inti atom terdiri atas proton yang bermuatan positif, dan neutron yang bermuatan netral (kecuali pada inti atom Hidrogen-1, yang tidak memiliki neutron). Elektron-elektron pada sebuah atom terikat pada inti atom oleh gaya elektromagnetik. Sekumpulan atom demikian pula dapat berikatan satu sama lainnya, dan membentuk sebuah molekul.
Atom yang mengandung jumlah proton dan elektron yang sama bersifat
netral, sedangkan yang mengandung jumlah proton dan elektron yang
berbeda bersifat positif atau negatif dan disebut sebagai ion.
Atom dikelompokkan berdasarkan jumlah proton dan neutron yang terdapat
pada inti atom tersebut. Jumlah proton pada atom menentukan unsur kimia atom tersebut, dan jumlah neutron menentukan isotop unsur tersebut.
Istilah atom berasal dari Bahasa Yunani (ἄτομος/átomos, α-τεμνω), yang berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat dibagi-bagi lagi. Konsep atom sebagai komponen yang tak dapat dibagi-bagi lagi pertama kali diajukan oleh para filsuf India dan Yunani. Pada abad ke-17 dan ke-18, para kimiawan meletakkan dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat tertentu tidak dapat dibagi-bagi lebih jauh lagi menggunakan metode-metode kimia. Selama akhir abad ke-19 dan awal abad ke-20, para fisikawan berhasil menemukan struktur dan komponen-komponen subatom di dalam atom, membuktikan bahwa 'atom' tidaklah tak dapat dibagi-bagi lagi. Prinsip-prinsip mekanika kuantum yang digunakan para fisikawan kemudian berhasil memodelkan atom.[1]
Dalam pengamatan sehari-hari, secara relatif atom dianggap sebuah objek yang sangat kecil yang memiliki massa yang secara proporsional kecil pula. Atom hanya dapat dipantau dengan menggunakan peralatan khusus seperti mikroskop gaya atom. Lebih dari 99,9% massa atom berpusat pada inti atom,[catatan 1] dengan proton dan neutron yang bermassa hampir sama. Setiap unsur paling tidak memiliki satu isotop dengan inti yang tidak stabil, yang dapat mengalami peluruhan radioaktif. Hal ini dapat mengakibatkan transmutasi, yang mengubah jumlah proton dan neutron pada inti.[2] Elektron yang terikat pada atom mengandung sejumlah aras energi, ataupun orbital, yang stabil dan dapat mengalami transisi di antara aras tersebut dengan menyerap ataupun memancarkan foton yang sesuai dengan perbedaan energi antara aras. Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur, dan memengaruhi sifat-sifat magnetis atom tersebut.
Rujukan paling awal mengenai konsep atom dapat ditilik kembali kepada zaman India kuno pada tahun 800 sebelum masehi,[4] yang dijelaskan dalam naskah filsafat Jainisme sebagai anu dan paramanu.[4][5] Aliran mazhab Nyaya dan Vaisesika mengembangkan teori yang menjelaskan bagaimana atom-atom bergabung menjadi benda-benda yang lebih kompleks.[6] Satu abad kemudian muncul rujukan mengenai atom di dunia Barat oleh Leukippos, yang kemudian oleh muridnya Demokritos pandangan tersebut disistematiskan. Kira-kira pada tahun 450 SM, Demokritos menciptakan istilah átomos (bahasa Yunani: ἄτομος), yang berarti "tidak dapat dipotong" ataupun "tidak dapat dibagi-bagi lagi". Teori Demokritos mengenai atom bukanlah usaha untuk menjabarkan suatu fenomena fisis secara rinci, melainkan suatu filosofi yang mencoba untuk memberikan jawaban atas perubahan-perubahan yang terjadi pada alam.[1] Filosofi serupa juga terjadi di India, namun demikian ilmu pengetahuan modern memutuskan untuk menggunakan istilah "atom" yang dicetuskan oleh Demokritos.[3]
Kemajuan lebih jauh pada pemahaman mengenai atom dimulai dengan berkembangnya ilmu kimia. Pada tahun 1661, Robert Boyle mempublikasikan buku The Sceptical Chymist yang berargumen bahwa materi-materi di dunia ini terdiri dari berbagai kombinasi "corpuscules", yaitu atom-atom yang berbeda. Hal ini berbeda dengan pandangan klasik yang berpendapat bahwa materi terdiri dari unsur-unsur udara, tanah, api, dan air.[7] Pada tahun 1789, istilah element (unsur) didefinisikan oleh seorang bangsawan dan peneliti Perancis, Antoine Lavoisier, sebagai bahan dasar yang tidak dapat dibagi-bagi lebih jauh lagi dengan menggunakan metode-metode kimia.[8]
 Pada tahun 1803, John Dalton
menggunakan konsep atom untuk menjelaskan mengapa unsur-unsur selalu
bereaksi dalam perbandingan yang bulat dan tetap, serta mengapa gas-gas
tertentu lebih larut dalam air dibandingkan dengan gas-gas lainnya. Ia
mengajukan pendapat bahwa setiap unsur mengandung atom-atom tunggal
unik, dan atom-atom tersebut selanjutnya dapat bergabung untuk membentuk
senyawa-senyawa kimia.[9][10]
Pada tahun 1803, John Dalton
menggunakan konsep atom untuk menjelaskan mengapa unsur-unsur selalu
bereaksi dalam perbandingan yang bulat dan tetap, serta mengapa gas-gas
tertentu lebih larut dalam air dibandingkan dengan gas-gas lainnya. Ia
mengajukan pendapat bahwa setiap unsur mengandung atom-atom tunggal
unik, dan atom-atom tersebut selanjutnya dapat bergabung untuk membentuk
senyawa-senyawa kimia.[9][10]
Teori partikel ini kemudian dikonfirmasikan lebih jauh lagi pada tahun 1827, yaitu ketika botaniwan Robert Brown menggunakan mikroskop untuk mengamati debu-debu yang mengambang di atas air dan menemukan bahwa debu-debu tersebut bergerak secara acak. Fenomena ini kemudian dikenal sebagai "Gerak Brown". Pada tahun 1877, J. Desaulx mengajukan pendapat bahwa fenomena ini disebabkan oleh gerak termal molekul air, dan pada tahun 1905 Albert Einstein membuat analisis matematika terhadap gerak ini.[11][12][13] Fisikawan Perancis Jean Perrin kemudian menggunakan hasil kerja Einstein untuk menentukan massa dan dimensi atom secara eksperimen, yang kemudian dengan pasti menjadi verifikasi atas teori atom Dalton.[14]
Berdasarkan hasil penelitiannya terhadap sinar katode, pada tahun 1897 J. J. Thomson menemukan elektron dan sifat-sifat subatomiknya. Hal ini meruntuhkan konsep atom sebagai satuan yang tidak dapat dibagi-bagi lagi.[15] Thomson percaya bahwa elektron-elektron terdistribusi secara merata di seluruh atom, dan muatan-muatannya diseimbangkan oleh keberadaan lautan muatan positif (model puding prem).
Namun pada tahun 1909, para peneliti di bawah arahan Ernest Rutherford menembakkan ion helium ke lembaran tipis emas, dan menemukan bahwa sebagian kecil ion tersebut dipantulkan dengan sudut pantulan yang lebih tajam dari yang apa yang diprediksikan oleh teori Thomson. Rutherford kemudian mengajukan pendapat bahwa muatan positif suatu atom dan kebanyakan massanya terkonsentrasi pada inti atom, dengan elektron yang mengitari inti atom seperti planet mengitari matahari. Muatan positif ion helium yang melewati inti padat ini haruslah dipantulkan dengan sudut pantulan yang lebih tajam. Pada tahun 1913, ketika bereksperimen dengan hasil proses peluruhan radioaktif, Frederick Soddy menemukan bahwa terdapat lebih dari satu jenis atom pada setiap posisi tabel periodik.[16] Istilah isotop kemudian diciptakan oleh Margaret Todd sebagai nama yang tepat untuk atom-atom yang berbeda namun merupakan satu unsur yang sama. J.J. Thomson selanjutnya menemukan teknik untuk memisahkan jenis-jenis atom tersebut melalui hasil kerjanya pada gas yang terionisasi.[17]
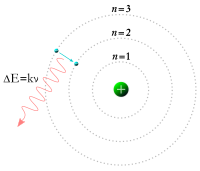 Sementara itu, pada tahun 1913 fisikawan Niels Bohr
mengkaji ulang model atom Rutherford dan mengajukan pendapat bahwa
elektron-elektron terletak pada orbit-orbit yang terkuantisasi serta
dapat meloncat dari satu orbit ke orbit lainnya, meskipun demikian tidak
dapat dengan bebas berputar spiral ke dalam maupun keluar dalam keadaan
transisi.[18]
Suatu elektron haruslah menyerap ataupun memancarkan sejumlah energi
tertentu untuk dapat melakukan transisi antara orbit-orbit yang tetap
ini. Apabila cahaya dari materi yang dipanaskan memancar melalui prisma, ia menghasilkan suatu spektrum multiwarna. Penampakan garis-garis spektrum tertentu ini berhasil dijelaskan oleh teori transisi orbital ini.[19]
Sementara itu, pada tahun 1913 fisikawan Niels Bohr
mengkaji ulang model atom Rutherford dan mengajukan pendapat bahwa
elektron-elektron terletak pada orbit-orbit yang terkuantisasi serta
dapat meloncat dari satu orbit ke orbit lainnya, meskipun demikian tidak
dapat dengan bebas berputar spiral ke dalam maupun keluar dalam keadaan
transisi.[18]
Suatu elektron haruslah menyerap ataupun memancarkan sejumlah energi
tertentu untuk dapat melakukan transisi antara orbit-orbit yang tetap
ini. Apabila cahaya dari materi yang dipanaskan memancar melalui prisma, ia menghasilkan suatu spektrum multiwarna. Penampakan garis-garis spektrum tertentu ini berhasil dijelaskan oleh teori transisi orbital ini.[19]
Ikatan kimia antar atom kemudian pada tahun 1916 dijelaskan oleh Gilbert Newton Lewis sebagai interaksi antara elektron-elektron atom tersebut.[20] Atas adanya keteraturan sifat-sifat kimiawi dalam tabel periode kimia,[21] kimiawan Amerika Irving Langmuir tahun 1919 berpendapat bahwa hal ini dapat dijelaskan apabila elektron-elektron pada sebuah atom saling berhubungan atau berkumpul dalam bentuk-bentuk tertentu. Sekelompok elektron diperkirakan menduduki satu set kelopak elektron di sekitar inti atom.
Percobaan Stern-Gerlach pada tahun 1922 memberikan bukti lebih jauh mengenai sifat-sifat kuantum atom. Ketika seberkas atom perak ditembakkan melalui medan magnet, berkas tersebut terpisah-pisah sesuai dengan arah momentum sudut atom (spin). Oleh karena arah spin adalah acak, berkas ini diharapkan menyebar menjadi satu garis. Namun pada kenyataannya berkas ini terbagi menjadi dua bagian, tergantung dari apakah spin atom tersebut berorientasi ke atas ataupun ke bawah.[22]
Pada tahun 1926, dengan menggunakan pemikiran Louis de Broglie bahwa partikel berperilaku seperti gelombang, Erwin Schrödinger mengembangkan suatu model atom matematis yang menggambarkan elektron sebagai gelombang tiga dimensi daripada sebagai titik-titik partikel. Konsekuensi penggunaan bentuk gelombang untuk menjelaskan elektron ini adalah bahwa adalah tidak mungkin untuk secara matematis menghitung posisi dan momentum partikel secara bersamaan. Hal ini kemudian dikenal sebagai prinsip ketidakpastian, yang dirumuskan oleh Werner Heisenberg pada 1926. Menurut konsep ini, untuk setiap pengukuran suatu posisi, seseorang hanya bisa mendapatkan kisaran nilai-nilai probabilitas momentum, demikian pula sebaliknya. Walaupun model ini sulit untuk divisualisasikan, ia dapat dengan baik menjelaskan sifat-sifat atom yang terpantau yang sebelumnya tidak dapat dijelaskan oleh teori mana pun. Oleh sebab itu, model atom yang menggambarkan elektron mengitari inti atom seperti planet mengitari matahari digugurkan dan digantikan oleh model orbital atom di sekitar inti di mana elektron paling berkemungkinan berada.[23][24]
Perkembangan pada spektrometri massa mengijinkan dilakukannya pengukuran massa atom secara tepat. Peralatan spektrometer ini menggunakan magnet untuk membelokkan trayektori berkas ion, dan banyaknya defleksi ditentukan dengan rasio massa atom terhadap muatannya. Kimiawan Francis William Aston menggunakan peralatan ini untuk menunjukkan bahwa isotop mempunyai massa yang berbeda. Perbedaan massa antar isotop ini berupa bilangan bulat, dan ia disebut sebagai kaidah bilangan bulat.[25] Penjelasan pada perbedaan massa isotop ini berhasil dipecahkan setelah ditemukannya neutron, suatu partikel bermuatan netral dengan massa yang hampir sama dengan proton, yaitu oleh James Chadwick pada tahun 1932. Isotop kemudian dijelaskan sebagai unsur dengan jumlah proton yang sama, namun memiliki jumlah neutron yang berbeda dalam inti atom.[26]
Pada tahun 1950-an, perkembangan pemercepat partikel dan detektor partikel mengijinkan para ilmuwan mempelajari dampak-dampak dari atom yang bergerak dengan energi yang tinggi.[27] Neutron dan proton kemudian diketahui sebagai hadron, yaitu komposit partikel-partikel kecil yang disebut sebagai kuark. Model-model standar fisika nuklir kemudian dikembangkan untuk menjelaskan sifat-sifat inti atom dalam hal interaksi partikel subatom ini.[28]
Sekitar tahun 1985, Steven Chu dkk. di Bell Labs mengembangkan sebuah teknik untuk menurunkan temperatur atom menggunakan laser. Pada tahun yang sama, sekelompok ilmuwan yang diketuai oleh William D. Phillips berhasil memerangkap atom natrium dalam perangkap magnet. Claude Cohen-Tannoudji kemudian menggabungkan kedua teknik tersebut untuk mendinginkan sejumlah kecil atom sampai beberapa mikrokelvin. Hal ini mengijinkan ilmuwan mempelajari atom dengan presisi yang sangat tinggi, yang pada akhirnya membawa para ilmuwan menemukan kondensasi Bose-Einstein.[29]
Dalam sejarahnya, sebuah atom tunggal sangatlah kecil untuk digunakan dalam aplikasi ilmiah. Namun baru-baru ini, berbagai peranti yang menggunakan sebuah atom tunggal logam yang dihubungkan dengan ligan-ligan organik (transistor elektron tunggal) telah dibuat.[30] Berbagai penelitian telah dilakukan untuk memerangkap dan memperlambat laju atom menggunakan pendinginan laser untuk mendapatkan pemahaman yang lebih baik mengenai sifat-sifat atom.[31]
 Artikel utama untuk bagian ini adalah: Partikel subatom
Walaupun awalnya kata atom berarti suatu partikel yang tidak
dapat dipotong-potong lagi menjadi partikel yang lebih kecil, dalam
terminologi ilmu pengetahuan modern, atom tersusun atas berbagai partikel subatom. Partikel-partikel penyusun atom ini adalah elektron, proton, dan neutron. Namun hidrogen-1 tidak mempunyai neutron. Demikian pula halnya pada ion hidrogen positif H+.
Artikel utama untuk bagian ini adalah: Partikel subatom
Walaupun awalnya kata atom berarti suatu partikel yang tidak
dapat dipotong-potong lagi menjadi partikel yang lebih kecil, dalam
terminologi ilmu pengetahuan modern, atom tersusun atas berbagai partikel subatom. Partikel-partikel penyusun atom ini adalah elektron, proton, dan neutron. Namun hidrogen-1 tidak mempunyai neutron. Demikian pula halnya pada ion hidrogen positif H+.
Dari kesemua partikel subatom ini, elektron adalah yang paling ringan, dengan massa elektron sebesar 9,11 × 10−31 kg dan mempunyai muatan negatif. Ukuran elektron sangatlah kecil sedemikiannya tiada teknik pengukuran yang dapat digunakan untuk mengukur ukurannya.[32] Proton memiliki muatan positif dan massa 1.836 kali lebih berat daripada elektron (1,6726 × 10−27 kg). Neutron tidak bermuatan listrik dan bermassa bebas 1.839 kali massa elektron[33] atau (1,6929 × 10−27 kg).
Dalam model standar fisika, baik proton dan neutron terdiri dari partikel elementer yang disebut kuark. Kuark termasuk kedalam golongan partikel fermion dan merupakan salah satu dari dua bahan penyusun materi dasar (yang lainnya adalah lepton). Terdapat enam jenis kuark dan tiap-tiap kuark tersebut memiliki muatan listri fraksional sebesar +2/3 ataupun −1/3. Proton terdiri dari dua kuark naik dan satu kuark turun, manakala neutron terdiri dari satu kuark naik dan dua kuark turun. Perbedaan komposisi kuark ini memengaruhi perbedaan massa dan muatan antara dua partikel tersebut. Kuark terikat bersama oleh gaya nuklir kuat yang diperantarai oleh gluon. Gluon adalah anggota dari boson tolok yang merupakan perantara gaya-gaya fisika.[34][35]
 Artikel utama untuk bagian ini adalah: Inti atom
Artikel utama untuk bagian ini adalah: Inti atom
 Inti atom terdiri atas proton dan neutron yang terikat bersama pada
pusat atom. Secara kolektif, proton dan neutron tersebut disebut sebagai
nukleon (partikel penyusun inti). Diameter inti atom berkisar antara 10-15 hingga 10-14m.[36] Jari-jari inti diperkirakan sama dengan
Inti atom terdiri atas proton dan neutron yang terikat bersama pada
pusat atom. Secara kolektif, proton dan neutron tersebut disebut sebagai
nukleon (partikel penyusun inti). Diameter inti atom berkisar antara 10-15 hingga 10-14m.[36] Jari-jari inti diperkirakan sama dengan ![\begin{smallmatrix}1,07 \sqrt[3]{A}\end{smallmatrix}](http://upload.wikimedia.org/math/b/5/6/b56e16e37f6036d3414eaf3c1d299f8a.png) fm, dengan A adalah jumlah nukleon.[37]
Hal ini sangatlah kecil dibandingkan dengan jari-jari atom.
Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik
potensial yang disebut gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38]
fm, dengan A adalah jumlah nukleon.[37]
Hal ini sangatlah kecil dibandingkan dengan jari-jari atom.
Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik
potensial yang disebut gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38]
Atom dari unsur kimia yang sama memiliki jumlah proton yang sama, disebut nomor atom. Suatu unsur dapat memiliki jumlah neutron yang bervariasi. Variasi ini disebut sebagai isotop. Jumlah proton dan neutron suatu atom akan menentukan nuklida atom tersebut, sedangkan jumlah neutron relatif terhadap jumlah proton akan menentukan stabilitas inti atom, dengan isotop unsur tertentu akan menjalankan peluruhan radioaktif.[39]
Neutron dan proton adalah dua jenis fermion yang berbeda. Asas pengecualian Pauli melarang adanya keberadaan fermion yang identik (seperti misalnya proton berganda) menduduki suatu keadaan fisik kuantum yang sama pada waktu yang sama. Oleh karena itu, setiap proton dalam inti atom harusnya menduduki keadaan kuantum yang berbeda dengan aras energinya masing-masing. Asas Pauli ini juga berlaku untuk neutron. Pelarangan ini tidak berlaku bagi proton dan neutron yang menduduki keadaan kuantum yang sama.[40]
Untuk atom dengan nomor atom yang rendah, inti atom yang memiliki jumlah proton lebih banyak daripada neutron berpotensi jatuh ke keadaan energi yang lebih rendah melalui peluruhan radioaktif yang menyebabkan jumlah proton dan neutron seimbang. Oleh karena itu, atom dengan jumlah proton dan neutron yang berimbang lebih stabil dan cenderung tidak meluruh. Namun, dengan meningkatnya nomor atom, gaya tolak-menolak antar proton membuat inti atom memerlukan proporsi neutron yang lebih tinggi lagi untuk menjaga stabilitasnya. Pada inti yang paling berat, rasio neutron per proton yang diperlukan untuk menjaga stabilitasnya akan meningkat menjadi 1,5.[40]
Jumlah proton dan neutron pada inti atom dapat diubah, walaupun hal
ini memerlukan energi yang sangat tinggi oleh karena gaya atraksinya
yang kuat. Fusi nuklir
terjadi ketika banyak partikel atom bergabung membentuk inti yang lebih
berat. Sebagai contoh, pada inti Matahari, proton memerlukan energi
sekitar 3–10 keV untuk mengatasi gaya tolak-menolak antar sesamanya dan
bergabung menjadi satu inti.[41] Fisi nuklir
merupakan kebalikan dari proses fusi. Pada fisi nuklir, inti dipecah
menjadi dua inti yang lebih kecil. Hal ini biasanya terjadi melalui
peluruhan radioaktif. Inti atom juga dapat diubah melalui penembakan
partikel subatom berenergi tinggi. Apabila hal ini mengubah jumlah
proton dalam inti, atom tersebut akan berubah unsurnya.[42][43]
Jika massa inti setelah terjadinya reaksi fusi lebih kecil daripada jumlah massa partikel awal penyusunnya, maka perbedaan ini disebabkan oleh pelepasan pancaran energi (misalnya sinar gamma), sebagaimana yang ditemukan pada rumus kesetaraan massa-energi Einstein, E = mc2, dengan m adalah massa yang hilang dan c adalah kecepatan cahaya. Defisit ini merupakan bagian dari energi pengikatan inti yang baru.[44]
Fusi dua inti yang menghasilkan inti yang lebih besar dengan nomor atom lebih rendah daripada besi dan nikel (jumlah total nukleon sama dengan 60) biasanya bersifat eksotermik, yang berarti bahwa proses ini melepaskan energi.[45] Adalah proses pelepasan energi inilah yang membuat fusi nuklir pada bintang dapat dipertahankan. Untuk inti yang lebih berat, energi pengikatan per nukleon dalam inti mulai menurun. Ini berarti bahwa proses fusi akan bersifat endotermik.[40]
Elektron dalam suatu atom ditarik oleh proton dalam inti atom melalui gaya elektromagnetik.
Gaya ini mengikat elektron dalam sumur potensi elektrostatik di sekitar
inti. Hal ini berarti bahwa energi luar diperlukan agar elektron dapat
lolos dari atom. Semakin dekat suatu elektron dalam inti, semakin besar
gaya atraksinya, sehingga elektron yang berada dekat dengan pusat sumur
potensi memerlukan energi yang lebih besar untuk lolos.
Elektron, sama seperti partikel lainnya, memiliki sifat seperti partikel maupun seperti gelombang (dualisme gelombang-partikel). Awan elektron adalah suatu daerah dalam sumur potensi di mana tiap-tiap elektron menghasilkan sejenis gelombang diam (yaitu gelombang yang tidak bergerak relatif terhadap inti) tiga dimensi. Perilaku ini ditentukan oleh orbital atom, yakni suatu fungsi matematika yang menghitung probabilitas suatu elektron akan muncul pada suatu lokasi tertentu ketika posisinya diukur.[46] Hanya akan ada satu himpunan orbital tertentu yang berada disekitar inti, karena pola-pola gelombang lainnya akan dengan cepat meluruh menjadi bentuk yang lebih stabil.[47]
Tiap-tiap orbital atom berkoresponden terhadap aras energi elektron tertentu. Elektron dapat berubah keadaannya ke aras energi yang lebih tinggi dengan menyerap sebuah foton.
Selain dapat naik menuju aras energi yang lebih tinggi, suatu elektron
dapat pula turun ke keadaan energi yang lebih rendah dengan memancarkan
energi yang berlebih sebagai foton.[47]
Energi yang diperlukan untuk melepaskan ataupun menambah satu elektron (energi pengikatan elektron) adalah lebih kecil daripada energi pengikatan nukleon. Sebagai contohnya, hanya diperlukan 13,6 eV untuk melepaskan elektron dari atom hidrogen.[48] Bandingkan dengan energi sebesar 2,3 MeV yang diperlukan untuk memecah inti deuterium.[49] Atom bermuatan listrik netral oleh karena jumlah proton dan elektronnya yang sama. Atom yang kekurangan ataupun kelebihan elektron disebut sebagai ion. Elektron yang terletak paling luar dari inti dapat ditransfer ataupun dibagi ke atom terdekat lainnya. Dengan cara inilah, atom dapat saling berikatan membentuk molekul.[50]
Dari sekitar 339 nuklida yang terbentuk secara alami di Bumi, 269 di antaranya belum pernah terpantau meluruh.[54] Pada unsur kimia, 80 dari unsur yang diketahui memiliki satu atau lebih isotop stabil. Unsur 43, 63, dan semua unsur lebih tinggi dari 83 tidak memiliki isotop stabil. Dua puluh tujuh unsur hanya memiliki satu isotop stabil, manakala jumlah isotop stabil yang paling banyak terpantau pada unsur timah dengan 10 jenis isotop stabil.[55]
Para kimiawan biasanya menggunakan satuan mol untuk menyatakan jumlah atom. Satu mol didefinisikan sebagai jumlah atom yang terdapat pada 12 gram persis karbon-12. Jumlah ini adalah sekitar 6,022 × 1023, yang dikenal pula dengan nama tetapan Avogadro. Dengan demikian suatu unsur dengan massa atom 1 u akan memiliki satu mol atom yang bermassa 0,001 kg. Sebagai contohnya, Karbon memiliki massa atom 12 u, sehingga satu mol karbon atom memiliki massa 0,012 kg.[56]
 Artikel utama untuk bagian ini adalah: Jari-jari atom
Atom tidak memiliki batasan luar yang jelas, sehingga dimensi atom
biasanya dideskripsikan sebagai jarak antara dua inti atom ketika dua
atom bergabung bersama dalam ikatan kimia. Jari-jari ini bervariasi tergantung pada jenis atom, jenis ikatan yang terlibat, jumlah atom di sekitarnya, dan spin atom.[60] Pada tabel periodik
unsur-unsur, jari-jari atom akan cenderung meningkat seiring dengan
meningkatnya periode (atas ke bawah). Sebaliknya jari-jari atom akan
cenderung meningkat seiring dengan menurunnya nomor golongan (kanan ke
kiri).[61] Oleh karena itu, atom yang terkecil adalah helium dengan jari-jari 32 pm, manakala yang terbesar adalah sesium dengan jari-jari 225 pm.[62] Dimensi ini ribuan kali lebih kecil daripada gelombang cahaya (400–700 nm), sehingga atom tidak dapat dilihat menggunakan mikroskop optik biasa. Namun, atom dapat dipantau menggunakan mikroskop gaya atom.
Artikel utama untuk bagian ini adalah: Jari-jari atom
Atom tidak memiliki batasan luar yang jelas, sehingga dimensi atom
biasanya dideskripsikan sebagai jarak antara dua inti atom ketika dua
atom bergabung bersama dalam ikatan kimia. Jari-jari ini bervariasi tergantung pada jenis atom, jenis ikatan yang terlibat, jumlah atom di sekitarnya, dan spin atom.[60] Pada tabel periodik
unsur-unsur, jari-jari atom akan cenderung meningkat seiring dengan
meningkatnya periode (atas ke bawah). Sebaliknya jari-jari atom akan
cenderung meningkat seiring dengan menurunnya nomor golongan (kanan ke
kiri).[61] Oleh karena itu, atom yang terkecil adalah helium dengan jari-jari 32 pm, manakala yang terbesar adalah sesium dengan jari-jari 225 pm.[62] Dimensi ini ribuan kali lebih kecil daripada gelombang cahaya (400–700 nm), sehingga atom tidak dapat dilihat menggunakan mikroskop optik biasa. Namun, atom dapat dipantau menggunakan mikroskop gaya atom.
Ukuran atom sangatlah kecil, sedemikian kecilnya lebar satu helai rambut dapat menampung sekitar 1 juta atom karbon.[63] Satu tetes air pula mengandung sekitar 2 × 1021 atom oksigen.[64] Intan satu karat dengan massa 2 × 10-4 kg mengandung sekitar 1022 atom karbon.[catatan 2] Jika sebuah apel diperbesar sampai seukuran besarnya Bumi, maka atom dalam apel tersebut akan terlihat sebesar ukuran apel awal tersebut.[65]
 Artikel utama untuk bagian ini adalah: Peluruhan radioaktif
Setiap unsur mempunyai satu atau lebih isotop berinti tak stabil yang
akan mengalami peluruhan radioaktif, menyebabkan inti melepaskan
partikel ataupun radiasi elektromagnetik. Radioaktivitas dapat terjadi
ketika jari-jari inti sangat besar dibandingkan dengan jari-jari gaya
kuat (hanya bekerja pada jarak sekitar 1 fm).[66]
Artikel utama untuk bagian ini adalah: Peluruhan radioaktif
Setiap unsur mempunyai satu atau lebih isotop berinti tak stabil yang
akan mengalami peluruhan radioaktif, menyebabkan inti melepaskan
partikel ataupun radiasi elektromagnetik. Radioaktivitas dapat terjadi
ketika jari-jari inti sangat besar dibandingkan dengan jari-jari gaya
kuat (hanya bekerja pada jarak sekitar 1 fm).[66]
Bentuk-bentuk peluruhan radioaktif yang paling umum adalah:[67][68]
Tiap-tiap isotop radioaktif mempunyai karakteristik periode waktu peluruhan (waktu paruh) yang merupakan lamanya waktu yang diperlukan oleh setengah jumlah sampel untuk meluruh habis. Proses peluruhan bersifat eksponensial, sehingga setelah dua waktu paruh, hanya akan tersisa 25% isotop.[66]
Medan magnet yang dihasilkan oleh suatu atom (disebut momen magnetik) ditentukan oleh kombinasi berbagai macam momentum sudut ini. Namun, kontribusi yang terbesar tetap berasal dari spin. Oleh karena elektron mematuhi asas pengecualian Pauli, yakni tiada dua elektron yang dapat ditemukan pada keadaan kuantum yang sama, pasangan elektron yang terikat satu sama lainnya memiliki spin yang berlawanan, dengan satu berspin naik, dan yang satunya lagi berspin turun. Kedua spin yang berlawanan ini akan saling menetralkan, sehingga momen dipol magnetik totalnya menjadi nol pada beberapa atom berjumlah elektron genap.[70]
Pada atom berelektron ganjil seperti besi, adanya keberadaan elektron yang tak berpasangan menyebabkan atom tersebut bersifat feromagnetik. Orbital-orbital atom di sekeliling atom tersebut saling bertumpang tindih dan penurunan keadaan energi dicapai ketika spin elektron yang tak berpasangan tersusun saling berjajar. Proses ini disebut sebagai interaksi pertukaran. Ketika momen magnetik atom feromagnetik tersusun berjajaran, bahan yang tersusun oleh atom ini dapat menghasilkan medan makroskopis yang dapat dideteksi. Bahan-bahan yang bersifat paramagnetik memiliki atom dengan momen magnetik yang tersusun acak, sehingga tiada medan magnet yang dihasilkan. Namun, momen magnetik tiap-tiap atom individu tersebut akan tersusun berjajar ketika diberikan medan magnet.[70][71]
Inti atom juga dapat memiliki spin. Biasanya spin inti tersusun secara acak oleh karena kesetimbangan termal. Namun, untuk unsur-unsur tertentu (seperti xenon-129), adalah mungkin untuk memolarisasi keadaan spin nuklir secara signifikan sehingga spin-spin tersebut tersusun berjajar dengan arah yang sama. Kondisi ini disebut sebagai hiperpolarisasi. Fenomena ini memiliki aplikasi yang penting dalam pencitraan resonansi magnetik.[72][73]
Agar suatu elektron dapat meloncat dari satu keadaan ke keadaan lainnya, ia haruslah menyerap ataupun memancarkan foton pada energi yang sesuai dengan perbedaan energi potensial antar dua aras tersebut. Energi foton yang dipancarkan adalah sebanding dengan frekuensinya.[75] Tiap-tiap unsur memiliki spektrum karakteristiknya masing-masing. Hal ini bergantung pada muatan inti, subkelopak yang terisi dengan elektron, interaksi elektromagnetik antar elektron, dan faktor-faktor lainnya.[76]
Ketika suatu spektrum energi yang berkelanjutan dipancarkan melalui suatu gas ataupun plasma, beberapa foton diserap oleh atom, menyebabkan elektron berpindah aras energi. Elektron yang tereksitasi akan secara spontan memancarkan energi ini sebagai foton dan jatuh kembali ke aras energi yang lebih rendah. Oleh karena itu, atom berperilaku seperti bahan penyaring yang akan membentuk sederetan pita absorpsi. Pengukuran spektroskopi terhadap kekuatan dan lebar pita spektrum mengijinkan penentuan komposisi dan sifat-sifat fisika suatu zat.[77]
Pemantauan cermat pada garis-garis spektrum menunjukkan bahwa beberapa memperlihatkan adanya pemisahan halus. Hal ini terjadi karena kopling spin-orbit yang merupakan interaksi antara spin dengan gerak elektron terluar.[78] Ketika suatu atom berada dalam medan magnet eksternal, garis-garis spektrum terpisah menjadi tiga atau lebih komponen. Hal ini disebut sebagai efek Zeeman. Efek Zeeman disebabkan oleh interaksi medan magnet dengan momen magnetik atom dan elektronnya. Beberapa atom dapat memiliki banyak konfigurasi elektron dengan aras energi yang sama, sehingga akan tampak sebagai satu garis spektrum. Interaksi medan magnet dengan atom akan menggeser konfigurasi-konfigurasi elektron menuju aras energi yang sedikit berbeda, menyebabkan garis spektrum berganda.[79] Keberadaan medan listrik eksternal dapat menyebabkan pemisahan dan pergeseran garis spektrum dengan mengubah aras energi elektron. Fenomena ini disebut sebagai efek Stark.[80]
Unsur-unsur kimia sering ditampilkan dalam tabel periodik yang menampilkan sifat-sifat kimia suatu unsur yang berpola. Unsur-unsur dengan jumlah elektron valensi yang sama dikelompokkan secara vertikel (disebut golongan). Unsur-unsur pada bagian terkanan tabel memiliki kelopak terluarnya terisi penuh, menyebabkan unsur-unsur tersebut cenderung bersifat inert (gas mulia).[83][84]
 Sejumlah atom ditemukan dalam keadaan materi yang berbeda-beda tergantung pada kondisi fisik benda, yakni suhu dan tekanan. Dengan mengubah kondisi tersebut, materi dapat berubah-ubah menjadi bentuk padat, cair, gas, dan plasma.[85]
Dalam tiap-tiap keadaan tersebut pula materi dapat memiliki berbagai
fase. Sebagai contohnya pada karbon padat, ia dapat berupa grafit maupun intan.[86]
Sejumlah atom ditemukan dalam keadaan materi yang berbeda-beda tergantung pada kondisi fisik benda, yakni suhu dan tekanan. Dengan mengubah kondisi tersebut, materi dapat berubah-ubah menjadi bentuk padat, cair, gas, dan plasma.[85]
Dalam tiap-tiap keadaan tersebut pula materi dapat memiliki berbagai
fase. Sebagai contohnya pada karbon padat, ia dapat berupa grafit maupun intan.[86]
Pada suhu mendekati nol mutlak, atom dapat membentuk kondensat Bose-Einstein, di mana efek-efek mekanika kuantum yang biasanya hanya terpantau pada skala atom terpantau secara makroskopis.[87][88] Kumpulan atom-atom yang dilewat-dinginkan ini berperilaku seperti satu atom super.[89]
Sebuah atom dapat diionisasi dengan melepaskan satu elektronnya. Muatan yang ada menyebabkan trayektori atom melengkung ketika ia melalui sebuah medan magnet. Jari-jari trayektori ion tersebut ditentukan oleh massa atom. Spektrometer massa menggunakan prinsip ini untuk menghitung rasio massa terhadap muatan ion. Apabila sampel tersebut mengandung sejumlah isotop, spektrometer massa dapat menentukan proporsi tiap-tiap isotop dengan mengukur intensitas berkas ion yang berbeda. Teknik untuk menguapkan atom meliputi spektroskopi emisi atomik plasma gandeng induktif (inductively coupled plasma atomic emission spectroscopy) dan spektrometri massa plasma gandeng induktif (inductively coupled plasma mass spectrometry), keduanya menggunakan plasma untuk menguapkan sampel analisis.[90]
Metode lainnya yang lebih selektif adalah spektroskopi pelepasan energi elektron (electron energy loss spectroscopy), yang mengukur pelepasan energi berkas elektron dalam suatu mikroskop elektron transmisi ketika ia berinteraksi dengan sampel. Tomografi kuar atom memiliki resolusi sub-nanometer dalam 3-D dan dapat secara kimiawi mengidentifikasi atom-atom individu menggunakan spektrometri massa waktu lintas.[91]
Spektrum keadaan tereksitasi dapat digunakan untuk menganalisa komposisi atom bintang yang jauh. Panjang gelombang cahaya tertentu yang dipancarkan oleh bintang dapat dipisahkan dan dicocokkan dengan transisi terkuantisasi atom gas bebas. Warna bintang kemudian dapat direplikasi menggunakan lampu lucutan gas yang mengandung unsur yang sama.[92] Helium pada Matahari ditemukan dengan menggunakan cara ini 23 tahun sebelum ia ditemukan di Bumi.[93]
 Artikel utama untuk bagian ini adalah: Nukleosintesis
Proton dan elektron yang stabil muncul satu detik setelah kejadian Dentuman Besar. Dalam masa waktu tiga menit sesudahnya, nukleosintesis Dentuman Besar kebanyakan menghasilkan helium, litium, dan deuterium, dan mungkin juga beberapa berilium dan boron.[99][100][101]
Atom pertama (dengan elektron yang terikat dengannya) secara teoritis
tercipta 380.000 tahun sesudah Dentuman Besar, yaitu ketika alam semesta
yang mengembang cukup dingin untuk mengijinkan elektron-elektron
terikat pada inti atom.[102] Sejak saat itulah, inti atom mulai bergabung dalam bintang-bintang melalui proses fusi nuklir dan menghasilkan unsur-unsur yang lebih berat sampai dengan besi.[103]
Artikel utama untuk bagian ini adalah: Nukleosintesis
Proton dan elektron yang stabil muncul satu detik setelah kejadian Dentuman Besar. Dalam masa waktu tiga menit sesudahnya, nukleosintesis Dentuman Besar kebanyakan menghasilkan helium, litium, dan deuterium, dan mungkin juga beberapa berilium dan boron.[99][100][101]
Atom pertama (dengan elektron yang terikat dengannya) secara teoritis
tercipta 380.000 tahun sesudah Dentuman Besar, yaitu ketika alam semesta
yang mengembang cukup dingin untuk mengijinkan elektron-elektron
terikat pada inti atom.[102] Sejak saat itulah, inti atom mulai bergabung dalam bintang-bintang melalui proses fusi nuklir dan menghasilkan unsur-unsur yang lebih berat sampai dengan besi.[103]
Isotop seperti litium-6 dihasilkan di ruang angkasa melalui spalasi sinar kosmis.[104] Hal ini terjadi ketika sebuah proton berenergi tinggi menumbuk inti atom, menyebabkan sejumlah besar nukleon berhamburan. Unsur yang lebih berat daripada besi dihasilkan di supernova melalui proses r dan di bintang-bintang AGB melalui proses s. Kedua-duanya melibatkan penangkapan neutron oleh inti atom.[105] Unsur-unsur seperti timbal kebanyakan dibentuk melalui peluruhan radioaktif unsur-unsur lain yang lebih berat.[106]
Terdapat sekelumit atom di Bumi yang pada awal pembentukannya tidak ada dan juga bukan merupakan akibat dari peluruhan radioaktif. Karbon-14 secara berkesinambungan dihasilkan oleh sinar kosmik di atmosfer.[110] Beberapa atom di Bumi secara buatan dihasilkan oleh reaktor ataupun senjata nuklir.[111][112] Dari semua Unsur-unsur transuranium yang bernomor atom lebih besar daripada 92, hanya plutonium dan neptunium sajalah yang terdapat di Bumi secara alami.[113][114] Unsur-unsur transuranium memiliki waktu paruh radioaktif yang lebih pendek daripada umur Bumi[115], sehingga unsur-unsur ini telah lama meluruh. Pengecualian terdapat pada plutonium-244 yang kemungkinan tersimpan dalam debu kosmik.[107] Kandungan alami plutonium dan neptunium dihasilkan dari penangkapan neutron dalam bijih uranium.[116]
Bumi mengandung sekitar 1,33 × 1050 atom.[117] Pada atmosfer planet, terdapat sejumlah kecil atom gas mulia seperti argon dan neon. Sisa 99% atom pada atmosfer bumi terikat dalam bentuk molekul, misalnya karbon dioksida, oksigen diatomik, dan nitrogen diatomik. Pada permukaan Bumi, atom-atom saling berikatan membentuk berbagai macam senyawa, meliputi air, garam, silikat, dan oksida. Atom juga dapat bergabung membentuk bahan-bahan yang tidak terdiri dari molekul, contohnya kristal dan logam padat ataupun cair.[118][119]
 Manakala isotop dengan nomor atom yang lebih tinggi daripada timbal (62) bersifat radioaktif, terdapat suatu "pulau stabilitas"
yang diajukan untuk beberapa unsur dengan nomor atom di atas 103.
Unsur-unsur super berat ini kemungkinan memiliki inti yang secara
relatif stabil terhadap peluruhan radioaktif.[120] Atom super berat yang stabil ini kemungkinan besar adalah unbiheksium, dengan 126 proton 184 neutron.[121]
Manakala isotop dengan nomor atom yang lebih tinggi daripada timbal (62) bersifat radioaktif, terdapat suatu "pulau stabilitas"
yang diajukan untuk beberapa unsur dengan nomor atom di atas 103.
Unsur-unsur super berat ini kemungkinan memiliki inti yang secara
relatif stabil terhadap peluruhan radioaktif.[120] Atom super berat yang stabil ini kemungkinan besar adalah unbiheksium, dengan 126 proton 184 neutron.[121]
Tiap-tiap partikel materi memiliki partikel antimaterinya masing-masing dengan muatan listrik yang berlawanan. Sehingga, positron adalah antielektron yang bermuatan positif, dan antiproton adalah proton yang bermuatan negatif, Ketika materi dan antimateri bertemu, keduanya akan saling memusnahkan. Terdapat ketidakseimbangan antara jumlah partikel materi dan antimateri. Ketidakseimbangan ini masih belum dipahami secara menyeluruh, walaupun terdapat teori bariogenesis yang memberikan penjelasan yang memungkinkan. Antimateri tidak pernah ditemukan secara alami.[122][123] Namun, pada tahun 1996, antihidrogen berhasil disintesis di laboratorium CERN di Jenewa.[124][125]
Terdapat pula atom-atom langka lainnya yang dibuat dengan menggantikan satu proton, neutron, ataupun elektron dengan partikel lain yang bermuatan sama. Sebagai contoh, elektron dapat digantikan dengan muon yang lebih berat, membentuk atom muon. Jenis atom ini dapat digunakan untuk menguji prediksi fisika.[126][127][128]
For other uses, see Atom (disambiguation).
| Helium atom | ||||||||
|---|---|---|---|---|---|---|---|---|
| An illustration of the helium atom, depicting the nucleus (pink) and the electron cloud distribution (black). The nucleus (upper right) in helium-4 is in reality spherically symmetric and closely resembles the electron cloud, although for more complicated nuclei this is not always the case. The black bar is one angstrom (10−10 m or 100 pm). | ||||||||
| Classification | ||||||||
|
||||||||
| Properties | ||||||||
|
The name atom comes from the Greek ἄτομος (atomos, "indivisible") from ἀ- (a-, "not") and τέμνω (temnō, "I cut"),[2] which means uncuttable, or indivisible, something that cannot be divided further.[3] The concept of an atom as an indivisible component of matter was first proposed by early Indian and Greek philosophers. In the 18th and 19th centuries, chemists provided a physical basis for this idea by showing that certain substances could not be further broken down by chemical methods, and they applied the ancient philosophical name of atom to the chemical entity. During the late 19th and early 20th centuries, physicists discovered subatomic components and structure inside the atom, thereby demonstrating that the chemical "atom" was divisible and that the name might not be appropriate.[4][5]. However, it was retained. This has led to some debate about whether the ancient philosophers, who intended to refer to fundamental individual objects with their concept of "atoms," were referring to modern chemical atoms, or something more like indivisible subatomic particles such as leptons or quarks, or even some more fundamental particle that has yet to be discovered.[6]
Chemical atoms, which in science now carry the simple name of "atom," are minuscule objects with diameters of a few tenths of a nanometer and tiny masses proportional to the volume implied by these dimensions. Atoms can only be observed individually using special instruments such as the scanning tunneling microscope. Over 99.94% of an atom's mass is concentrated in the nucleus,[note 1] with protons and neutrons having roughly equal mass. Each element has at least one isotope with an unstable nucleus that can undergo radioactive decay. This can result in a transmutation that changes the number of protons or neutrons in a nucleus.[7] Electrons that are bound to atoms possess a set of stable energy levels, or orbitals, and can undergo transitions between them by absorbing or emitting photons that match the energy differences between the levels. The electrons determine the chemical properties of an element, and strongly influence an atom's magnetic properties. The principles of quantum mechanics have been successfully used to model the observed properties of the atom.
Contents |
History
Main article: Atomic theory
Atomism
Main article: Atomism
The concept that matter is composed of discrete units and cannot be divided into arbitrarily tiny quantities has been around for millennia, but these ideas were founded in abstract, philosophical reasoning rather than experimentation and empirical observation.
The nature of atoms in philosophy varied considerably over time and
between cultures and schools, and often had spiritual elements.
Nevertheless, the basic idea of the atom was adopted by scientists
thousands of years later because it elegantly explained new discoveries
in the field of chemistry.[8]References to the concept of atoms date back to ancient Greece and India. In India, the Ājīvika, Jain, and Cārvāka schools of atomism may date back to the 6th century BCE.[9] The Nyaya and Vaisheshika schools later developed theories on how atoms combined into more complex objects.[10] In the West, the references to atoms emerged in the 5th century BCE with Leucippus, whose student, Democritus, systematized his views. In approximately 450 BCE, Democritus coined the term átomos (Greek: ἄτομος), which means "uncuttable" or "the smallest indivisible particle of matter". Although the Indian and Greek concepts of the atom were based purely on philosophy, modern science has retained the name coined by Democritus.[8]
Corpuscularianism is the postulate, expounded in the 13th-century by the alchemist Pseudo-Geber (Geber),[11] sometimes identified with Paul of Taranto, that all physical bodies possess an inner and outer layer of minute particles or corpuscles.[12] Corpuscularianism is similar to the theory of atomism, except that where atoms were supposed to be indivisible, corpuscles could in principle be divided. In this manner, for example, it was theorized that mercury could penetrate into metals and modify their inner structure.[13] Corpuscularianism stayed a dominant theory over the next several hundred years.
In 1661, natural philosopher Robert Boyle published The Sceptical Chymist in which he argued that matter was composed of various combinations of different "corpuscules" or atoms, rather than the classical elements of air, earth, fire and water.[14] During the 1670s corpuscularianism was used by Isaac Newton in his development of the corpuscular theory of light.[12][15]
Origin of scientific theory

Various atoms and molecules as depicted in John Dalton's A New System of Chemical Philosophy (1808), one of the earliest scientific works on atomic theory
In 1805, English instructor and natural philosopher John Dalton used the concept of atoms to explain why elements always react in ratios of small whole numbers (the law of multiple proportions) and why certain gases dissolved better in water than others. He proposed that each element consists of atoms of a single, unique type, and that these atoms can join together to form chemical compounds.[17][18] Dalton is considered the originator of modern atomic theory.[19]
Dalton's atomic hypothesis did not specify the size of atoms. Common sense indicated they must be very small, but nobody knew how small. Therefore it was a major landmark when in 1865 Johann Josef Loschmidt measured the size of the molecules that make up air.
An additional line of reasoning in support of particle theory (and by extension atomic theory) began in 1827 when botanist Robert Brown used a microscope to look at dust grains floating in water and discovered that they moved about erratically—a phenomenon that became known as "Brownian motion". J. Desaulx suggested in 1877 that the phenomenon was caused by the thermal motion of water molecules, and in 1905 Albert Einstein produced the first mathematical analysis of the motion.[20][21][22] French physicist Jean Perrin used Einstein's work to experimentally determine the mass and dimensions of atoms, thereby conclusively verifying Dalton's atomic theory.[23]

Mendeleev's first periodic table (1869)
Subcomponents and quantum theory

A generic atomic planetary model, or the Rutherford model
In 1909, Hans Geiger and Ernest Marsden, under the direction of physicist Ernest Rutherford, bombarded a sheet of gold foil with alpha rays—by then known to be positively charged helium atoms—and discovered that a small percentage of these particles were deflected through much larger angles than was predicted using Thomson's proposal. Rutherford interpreted the gold foil experiment as suggesting that the positive charge of a heavy gold atom and most of its mass was concentrated in a nucleus at the center of the atom—the Rutherford model.[27]
While experimenting with the products of radioactive decay, in 1913 radiochemist Frederick Soddy discovered that there appeared to be more than one type of atom at each position on the periodic table.[28] The term isotope was coined by Margaret Todd as a suitable name for different atoms that belong to the same element. J.J. Thomson created a technique for separating atom types through his work on ionized gases, which subsequently led to the discovery of stable isotopes.[29]

A Bohr model of the hydrogen atom, showing an electron jumping between fixed orbits and emitting a photon of energy with a specific frequency
Later in the same year Henry Moseley provided additional experimental evidence in favor of Niels Bohr's theory. These results refined Ernest Rutherford's and Antonius Van den Broek's model, which proposed that the atom contains in its nucleus a number of positive nuclear charges that is equal to its (atomic) number in the periodic table. Until these experiments, atomic number was not known to be a physical and experimental quantity. That it is equal to the atomic nuclear charge remains the accepted atomic model today.[32]
Chemical bonds between atoms were now explained, by Gilbert Newton Lewis in 1916, as the interactions between their constituent electrons.[33] As the chemical properties of the elements were known to largely repeat themselves according to the periodic law,[34] in 1919 the American chemist Irving Langmuir suggested that this could be explained if the electrons in an atom were connected or clustered in some manner. Groups of electrons were thought to occupy a set of electron shells about the nucleus.[35]
The Stern–Gerlach experiment of 1922 provided further evidence of the quantum nature of the atom. When a beam of silver atoms was passed through a specially shaped magnetic field, the beam was split based on the direction of an atom's angular momentum, or spin. As this direction is random, the beam could be expected to spread into a line. Instead, the beam was split into two parts, depending on whether the atomic spin was oriented up or down.[36]
In 1924, Louis de Broglie proposed that all particles behave to an extent like waves. In 1926, Erwin Schrödinger used this idea to develop a mathematical model of the atom that described the electrons as three-dimensional waveforms rather than point particles. A consequence of using waveforms to describe particles is that it is mathematically impossible to obtain precise values for both the position and momentum of a particle at the same time; this became known as the uncertainty principle, formulated by Werner Heisenberg in 1926. In this concept, for a given accuracy in measuring a position one could only obtain a range of probable values for momentum, and vice versa. This model was able to explain observations of atomic behavior that previous models could not, such as certain structural and spectral patterns of atoms larger than hydrogen. Thus, the planetary model of the atom was discarded in favor of one that described atomic orbital zones around the nucleus where a given electron is most likely to be observed.[37][38]
The development of the mass spectrometer allowed the exact mass of atoms to be measured. The device uses a magnet to bend the trajectory of a beam of ions, and the amount of deflection is determined by the ratio of an atom's mass to its charge. The chemist Francis William Aston used this instrument to show that isotopes had different masses. The atomic mass of these isotopes varied by integer amounts, called the whole number rule.[39] The explanation for these different isotopes awaited the discovery of the neutron, a neutral-charged particle with a mass similar to the proton, by the physicist James Chadwick in 1932. Isotopes were then explained as elements with the same number of protons, but different numbers of neutrons within the nucleus.[40]
Fission, high-energy physics and condensed matter
In 1938, the German chemist Otto Hahn, a student of Rutherford, directed neutrons onto uranium atoms expecting to get transuranium elements. Instead, his chemical experiments showed barium as a product.[41] A year later, Lise Meitner and her nephew Otto Frisch verified that Hahn's result were the first experimental nuclear fission.[42][43] In 1944, Hahn received the Nobel prize in chemistry. Despite Hahn's efforts, the contributions of Meitner and Frisch were not recognized.[44]In the 1950s, the development of improved particle accelerators and particle detectors allowed scientists to study the impacts of atoms moving at high energies.[45] Neutrons and protons were found to be hadrons, or composites of smaller particles called quarks. The standard model of particle physics was developed that so far has successfully explained the properties of the nucleus in terms of these sub-atomic particles and the forces that govern their interactions.[46]
Components
Subatomic particles
Main article: Subatomic particle
Though the word atom originally denoted a particle that cannot
be cut into smaller particles, in modern scientific usage the atom is
composed of various subatomic particles. The constituent particles of an atom are the electron, the proton and the neutron. However, the hydrogen-1 atom has no neutrons and a positive hydrogen ion has no electrons.The electron is by far the least massive of these particles at 9.11×10−31 kg, with a negative electrical charge and a size that is too small to be measured using available techniques.[47] Protons have a positive charge and a mass 1,836 times that of the electron, at 1.6726×10−27 kg, although this can be reduced by changes to the energy binding the proton into an atom. Neutrons have no electrical charge and have a free mass of 1,839 times the mass of electrons,[48] or 1.6929×10−27 kg. Neutrons and protons have comparable dimensions—on the order of 2.5×10−15 m—although the 'surface' of these particles is not sharply defined.[49]
In the Standard Model of physics, electrons are truly elementary particles with no internal structure. However, both protons and neutrons are composite particles composed of elementary particles called quarks. There are two types of quarks in atoms, each having a fractional electric charge. Protons are composed of two up quarks (each with charge +2⁄3) and one down quark (with a charge of −1⁄3). Neutrons consist of one up quark and two down quarks. This distinction accounts for the difference in mass and charge between the two particles.[50][51]
The quarks are held together by the strong interaction (or strong force), which is mediated by gluons. The protons and neutrons, in turn, are held to each other in the nucleus by the nuclear force, which is a residuum of the strong force that has somewhat different range-properties (see the article on the nuclear force for more). The gluon is a member of the family of gauge bosons, which are elementary particles that mediate physical forces.[50][51]
Nucleus
Main article: Atomic nucleus

The binding energy needed for a nucleon to escape the nucleus, for various isotopes
![\scriptstyle 1.07 \sqrt[3]{A} \text{ fm}](http://upload.wikimedia.org/math/b/9/4/b945dd398743b9af9d401ac649aa2b86.png) , where A is the total number of nucleons.[52] This is much smaller than the radius of the atom, which is on the order of 105 fm. The nucleons are bound together by a short-ranged attractive potential called the residual strong force. At distances smaller than 2.5 fm this force is much more powerful than the electrostatic force that causes positively charged protons to repel each other.[53]
, where A is the total number of nucleons.[52] This is much smaller than the radius of the atom, which is on the order of 105 fm. The nucleons are bound together by a short-ranged attractive potential called the residual strong force. At distances smaller than 2.5 fm this force is much more powerful than the electrostatic force that causes positively charged protons to repel each other.[53]Atoms of the same element have the same number of protons, called the atomic number. Within a single element, the number of neutrons may vary, determining the isotope of that element. The total number of protons and neutrons determine the nuclide. The number of neutrons relative to the protons determines the stability of the nucleus, with certain isotopes undergoing radioactive decay.[54]
The neutron and the proton are different types of fermions. The Pauli exclusion principle is a quantum mechanical effect that prohibits identical fermions, such as multiple protons, from occupying the same quantum physical state at the same time. Thus every proton in the nucleus must occupy a different state, with its own energy level, and the same rule applies to all of the neutrons. This prohibition does not apply to a proton and neutron occupying the same quantum state.[55]
For atoms with low atomic numbers, a nucleus that has a different number of protons than neutrons can potentially drop to a lower energy state through a radioactive decay that causes the number of protons and neutrons to more closely match. As a result, atoms with roughly matching numbers of protons and neutrons are more stable against decay. However, with increasing atomic number, the mutual repulsion of the protons requires an increasing proportion of neutrons to maintain the stability of the nucleus, which modifies this trend. Thus, there are no stable nuclei with equal proton and neutron numbers above atomic number Z = 20 (calcium); and as Z increases toward the heaviest nuclei, the ratio of neutrons per proton required for stability increases to about 1.5.[55]

Illustration of a nuclear fusion process that forms a deuterium nucleus,
consisting of a proton and a neutron, from two protons. A positron (e+)—an antimatter electron—is emitted along with an electron neutrino.
If the mass of the nucleus following a fusion reaction is less than the sum of the masses of the separate particles, then the difference between these two values can be emitted as a type of usable energy (such as a gamma ray, or the kinetic energy of a beta particle), as described by Albert Einstein's mass–energy equivalence formula, E = mc2, where m is the mass loss and c is the speed of light. This deficit is part of the binding energy of the new nucleus, and it is the non-recoverable loss of the energy that causes the fused particles to remain together in a state that requires this energy to separate.[59]
The fusion of two nuclei that create larger nuclei with lower atomic numbers than iron and nickel—a total nucleon number of about 60—is usually an exothermic process that releases more energy than is required to bring them together.[60] It is this energy-releasing process that makes nuclear fusion in stars a self-sustaining reaction. For heavier nuclei, the binding energy per nucleon in the nucleus begins to decrease. That means fusion processes producing nuclei that have atomic numbers higher than about 26, and atomic masses higher than about 60, is an endothermic process. These more massive nuclei can not undergo an energy-producing fusion reaction that can sustain the hydrostatic equilibrium of a star.[55]
Electron cloud
Main articles: Atomic orbital and Electron configuration

A potential well, showing, according to classical mechanics, the minimum energy V(x) needed to reach each position x. Classically, a particle with energy E is constrained to a range of positions between x1 and x2.
Electrons, like other particles, have properties of both a particle and a wave. The electron cloud is a region inside the potential well where each electron forms a type of three-dimensional standing wave—a wave form that does not move relative to the nucleus. This behavior is defined by an atomic orbital, a mathematical function that characterises the probability that an electron appears to be at a particular location when its position is measured.[61] Only a discrete (or quantized) set of these orbitals exist around the nucleus, as other possible wave patterns rapidly decay into a more stable form.[62] Orbitals can have one or more ring or node structures, and they differ from each other in size, shape and orientation.[63]

Wave functions of the first five atomic orbitals. The three 2p orbitals each display a single angular node that has an orientation and a minimum at the center.
The amount of energy needed to remove or add an electron—the electron binding energy—is far less than the binding energy of nucleons. For example, it requires only 13.6 eV to strip a ground-state electron from a hydrogen atom,[64] compared to 2.23 million eV for splitting a deuterium nucleus.[65] Atoms are electrically neutral if they have an equal number of protons and electrons. Atoms that have either a deficit or a surplus of electrons are called ions. Electrons that are farthest from the nucleus may be transferred to other nearby atoms or shared between atoms. By this mechanism, atoms are able to bond into molecules and other types of chemical compounds like ionic and covalent network crystals.[66]
Properties
Nuclear properties
Main articles: Isotope, Stable isotope, List of nuclides, and List of elements by stability of isotopes
By definition, any two atoms with an identical number of protons in their nuclei belong to the same chemical element. Atoms with equal numbers of protons but a different number of neutrons
are different isotopes of the same element. For example, all hydrogen
atoms admit exactly one proton, but isotopes exist with no neutrons (hydrogen-1, by far the most common form,[67] also called protium), one neutron (deuterium), two neutrons (tritium) and more than two neutrons. The known elements form a set of atomic numbers, from the single proton element hydrogen up to the 118-proton element ununoctium.[68] All known isotopes of elements with atomic numbers greater than 82 are radioactive.[69][70]About 339 nuclides occur naturally on Earth,[71] of which 253 (about 75%) have not been observed to decay, and are referred to as "stable isotopes". However, only 90 of these nuclides are stable to all decay, even in theory. Another 163 (bringing the total to 253) have not been observed to decay, even though in theory it is energetically possible. These are also formally classified as "stable". An additional 35 radioactive nuclides have half-lives longer than 80 million years, and are long-lived enough to be present from the birth of the solar system. This collection of 288 nuclides are known as primordial nuclides. Finally, an additional 51 short-lived nuclides are known to occur naturally, as daughter products of primordial nuclide decay (such as radium from uranium), or else as products of natural energetic processes on Earth, such as cosmic ray bombardment (for example, carbon-14).[72][note 2]
For 80 of the chemical elements, at least one stable isotope exists. As a rule, there is only a handful of stable isotopes for each of these elements, the average being 3.2 stable isotopes per element. Twenty-six elements have only a single stable isotope, while the largest number of stable isotopes observed for any element is ten, for the element tin. Elements 43, 61, and all elements numbered 83 or higher have no stable isotopes.[73][page needed]
Stability of isotopes is affected by the ratio of protons to neutrons, and also by the presence of certain "magic numbers" of neutrons or protons that represent closed and filled quantum shells. These quantum shells correspond to a set of energy levels within the shell model of the nucleus; filled shells, such as the filled shell of 50 protons for tin, confers unusual stability on the nuclide. Of the 253 known stable nuclides, only four have both an odd number of protons and odd number of neutrons: hydrogen-2 (deuterium), lithium-6, boron-10 and nitrogen-14. Also, only four naturally occurring, radioactive odd-odd nuclides have a half-life over a billion years: potassium-40, vanadium-50, lanthanum-138 and tantalum-180m. Most odd-odd nuclei are highly unstable with respect to beta decay, because the decay products are even-even, and are therefore more strongly bound, due to nuclear pairing effects.[73][page needed]
Mass
Main articles: Atomic mass and mass number
The large majority of an atom's mass comes from the protons and
neutrons that make it up. The total number of these particles (called
"nucleons") in a given atom is called the mass number.
The mass number is a simple whole number, and has units of "nucleons."
An example of use of a mass number is "carbon-12," which has 12 nucleons
(six protons and six neutrons).The actual mass of an atom at rest is often expressed using the unified atomic mass unit (u), which is also called a dalton (Da). This unit is defined as a twelfth of the mass of a free neutral atom of carbon-12, which is approximately 1.66×10−27 kg.[74] Hydrogen-1, the lightest isotope of hydrogen and the atom with the lowest mass, has an atomic weight of 1.007825 u.[75] The value of this number is called the atomic mass. A given atom has an atomic mass approximately equal (within 1%) to its mass number times the mass of the atomic mass unit. However, this number will not be an exact whole number except in the case of carbon-12 (see below)[76] The heaviest stable atom is lead-208,[69] with a mass of 207.9766521 u.[77]
As even the most massive atoms are far too light to work with directly, chemists instead use the unit of moles. One mole of atoms of any element always has the same number of atoms (about 6.022×1023). This number was chosen so that if an element has an atomic mass of 1 u, a mole of atoms of that element has a mass close to one gram. Because of the definition of the unified atomic mass unit, each carbon-12 atom has an atomic mass of exactly 12 u, and so a mole of carbon-12 atoms weighs exactly 0.012 kg.[74][page needed]
Shape and size
Main article: Atomic radius
Atoms lack a well-defined outer boundary, so their dimensions are usually described in terms of an atomic radius.
This is a measure of the distance out to which the electron cloud
extends from the nucleus. However, this assumes the atom to exhibit a
spherical shape, which is only obeyed for atoms in vacuum or free space.
Atomic radii may be derived from the distances between two nuclei when
the two atoms are joined in a chemical bond.
The radius varies with the location of an atom on the atomic chart, the
type of chemical bond, the number of neighboring atoms (coordination number) and a quantum mechanical property known as spin.[78] On the periodic table of the elements, atom size tends to increase when moving down columns, but decrease when moving across rows (left to right).[79] Consequently, the smallest atom is helium with a radius of 32 pm, while one of the largest is caesium at 225 pm.[80]When subjected to external fields, like an electrical field, the shape of an atom may deviate from that of a sphere. The deformation depends on the field magnitude and the orbital type of outer shell electrons, as shown by group-theoretical considerations. Aspherical deviations might be elicited for instance in crystals, where large crystal-electrical fields may occur at low-symmetry lattice sites.[81] Significant ellipsoidal deformations have recently been shown to occur for sulfur ions in pyrite-type compounds.[82]
Atomic dimensions are thousands of times smaller than the wavelengths of light (400–700 nm) so they can not be viewed using an optical microscope. However, individual atoms can be observed using a scanning tunneling microscope. To visualize the minuteness of the atom, consider that a typical human hair is about 1 million carbon atoms in width.[83] A single drop of water contains about 2 sextillion (2×1021) atoms of oxygen, and twice the number of hydrogen atoms.[84] A single carat diamond with a mass of 2×10−4 kg contains about 10 sextillion (1022) atoms of carbon.[note 3] If an apple were magnified to the size of the Earth, then the atoms in the apple would be approximately the size of the original apple.[85]
Radioactive decay
Main article: Radioactive decay

This diagram shows the half-life (T½) of various isotopes with Z protons and N neutrons.
The most common forms of radioactive decay are:[87][88]
- Alpha decay is caused when the nucleus emits an alpha particle, which is a helium nucleus consisting of two protons and two neutrons. The result of the emission is a new element with a lower atomic number.
- Beta decay is regulated by the weak force, and results from a transformation of a neutron into a proton, or a proton into a neutron. The first is accompanied by the emission of an electron and an antineutrino, while the second causes the emission of a positron and a neutrino. The electron or positron emissions are called beta particles. Beta decay either increases or decreases the atomic number of the nucleus by one. A common analog of positron beta decay in nuclei that are proton-rich is electron capture where an electron is absorbed by the nucleus rather than a positron emitted. A neutrino is still emitted in this process, and a proton again changes to a neutron.
- Gamma decay results from a change in the energy level of the nucleus to a lower state, resulting in the emission of electromagnetic radiation. This can occur following the emission of an alpha or a beta particle from radioactive decay.
Each radioactive isotope has a characteristic decay time period—the half-life—that is determined by the amount of time needed for half of a sample to decay. This is an exponential decay process that steadily decreases the proportion of the remaining isotope by 50% every half-life. Hence after two half-lives have passed only 25% of the isotope is present, and so forth.[86]
Magnetic moment
Main articles: Electron magnetic dipole moment and Nuclear magnetic moment
Elementary particles possess an intrinsic quantum mechanical property known as spin. This is analogous to the angular momentum of an object that is spinning around its center of mass,
although strictly speaking these particles are believed to be
point-like and cannot be said to be rotating. Spin is measured in units
of the reduced Planck constant (ħ), with electrons, protons and neutrons all having spin ½ ħ, or "spin-½". In an atom, electrons in motion around the nucleus possess orbital angular momentum in addition to their spin, while the nucleus itself possesses angular momentum due to its nuclear spin.[89]The magnetic field produced by an atom—its magnetic moment—is determined by these various forms of angular momentum, just as a rotating charged object classically produces a magnetic field. However, the most dominant contribution comes from spin. Due to the nature of electrons to obey the Pauli exclusion principle, in which no two electrons may be found in the same quantum state, bound electrons pair up with each other, with one member of each pair in a spin up state and the other in the opposite, spin down state. Thus these spins cancel each other out, reducing the total magnetic dipole moment to zero in some atoms with even number of electrons.[90]
In ferromagnetic elements such as iron, an odd number of electrons leads to an unpaired electron and a net overall magnetic moment. The orbitals of neighboring atoms overlap and a lower energy state is achieved when the spins of unpaired electrons are aligned with each other, a process known as an exchange interaction. When the magnetic moments of ferromagnetic atoms are lined up, the material can produce a measurable macroscopic field. Paramagnetic materials have atoms with magnetic moments that line up in random directions when no magnetic field is present, but the magnetic moments of the individual atoms line up in the presence of a field.[90][91]
The nucleus of an atom can also have a net spin. Normally these nuclei are aligned in random directions because of thermal equilibrium. However, for certain elements (such as xenon-129) it is possible to polarize a significant proportion of the nuclear spin states so that they are aligned in the same direction—a condition called hyperpolarization. This has important applications in magnetic resonance imaging.[92][93]
Energy levels
Main articles: Energy level and Atomic spectral line
When an electron is bound to an atom, it has a potential energy
that is inversely proportional to its distance from the nucleus. This
is measured by the amount of energy needed to unbind the electron from
the atom, and is usually given in units of electronvolts
(eV). In the quantum mechanical model, a bound electron can only occupy
a set of states centered on the nucleus, and each state corresponds to a
specific energy level. The lowest energy state of a bound electron is
called the ground state, while an electron at a higher energy level is
in an excited state.[94]For an electron to transition between two different states, it must absorb or emit a photon at an energy matching the difference in the potential energy of those levels. The energy of an emitted photon is proportional to its frequency, so these specific energy levels appear as distinct bands in the electromagnetic spectrum.[95] Each element has a characteristic spectrum that can depend on the nuclear charge, subshells filled by electrons, the electromagnetic interactions between the electrons and other factors.[96]
When a continuous spectrum of energy is passed through a gas or plasma, some of the photons are absorbed by atoms, causing electrons to change their energy level. Those excited electrons that remain bound to their atom spontaneously emit this energy as a photon, traveling in a random direction, and so drop back to lower energy levels. Thus the atoms behave like a filter that forms a series of dark absorption bands in the energy output. (An observer viewing the atoms from a view that does not include the continuous spectrum in the background, instead sees a series of emission lines from the photons emitted by the atoms.) Spectroscopic measurements of the strength and width of spectral lines allow the composition and physical properties of a substance to be determined.[97]
Close examination of the spectral lines reveals that some display a fine structure splitting. This occurs because of spin-orbit coupling, which is an interaction between the spin and motion of the outermost electron.[98] When an atom is in an external magnetic field, spectral lines become split into three or more components; a phenomenon called the Zeeman effect. This is caused by the interaction of the magnetic field with the magnetic moment of the atom and its electrons. Some atoms can have multiple electron configurations with the same energy level, which thus appear as a single spectral line. The interaction of the magnetic field with the atom shifts these electron configurations to slightly different energy levels, resulting in multiple spectral lines.[99] The presence of an external electric field can cause a comparable splitting and shifting of spectral lines by modifying the electron energy levels, a phenomenon called the Stark effect.[100]
If a bound electron is in an excited state, an interacting photon with the proper energy can cause stimulated emission of a photon with a matching energy level. For this to occur, the electron must drop to a lower energy state that has an energy difference matching the energy of the interacting photon. The emitted photon and the interacting photon then move off in parallel and with matching phases. That is, the wave patterns of the two photons are synchronized. This physical property is used to make lasers, which can emit a coherent beam of light energy in a narrow frequency band.[101]
Valence and bonding behavior
Main articles: Valence (chemistry) and Chemical bond
The outermost electron shell of an atom in its uncombined state is
known as the valence shell, and the electrons in that shell are called valence electrons. The number of valence electrons determines the bonding behavior with other atoms. Atoms tend to chemically react with each other in a manner that fills (or empties) their outer valence shells.[102]
For example, a transfer of a single electron between atoms is a useful
approximation for bonds that form between atoms with one-electron more
than a filled shell, and others that are one-electron short of a full
shell, such as occurs in the compound sodium chloride
and other chemical ionic salts. However, many elements display multiple
valences, or tendencies to share differing numbers of electrons in
different compounds. Thus, chemical bonding
between these elements takes many forms of electron-sharing that are
more than simple electron transfers. Examples include the element carbon
and the organic compounds.[103]The chemical elements are often displayed in a periodic table that is laid out to display recurring chemical properties, and elements with the same number of valence electrons form a group that is aligned in the same column of the table. (The horizontal rows correspond to the filling of a quantum shell of electrons.) The elements at the far right of the table have their outer shell completely filled with electrons, which results in chemically inert elements known as the noble gases.[104][105]
States
Main articles: State of matter and Phase (matter)

Snapshots illustrating the formation of a Bose–Einstein condensate
At temperatures close to absolute zero, atoms can form a Bose–Einstein condensate, at which point quantum mechanical effects, which are normally only observed at the atomic scale, become apparent on a macroscopic scale.[108][109] This super-cooled collection of atoms then behaves as a single super atom, which may allow fundamental checks of quantum mechanical behavior.[110]
Identification

Scanning tunneling microscope image showing the individual atoms making up this gold (100) surface. Reconstruction causes the surface atoms to deviate from the bulk crystal structure and arrange in columns several atoms wide with pits between them.
An atom can be ionized by removing one of its electrons. The electric charge causes the trajectory of an atom to bend when it passes through a magnetic field. The radius by which the trajectory of a moving ion is turned by the magnetic field is determined by the mass of the atom. The mass spectrometer uses this principle to measure the mass-to-charge ratio of ions. If a sample contains multiple isotopes, the mass spectrometer can determine the proportion of each isotope in the sample by measuring the intensity of the different beams of ions. Techniques to vaporize atoms include inductively coupled plasma atomic emission spectroscopy and inductively coupled plasma mass spectrometry, both of which use a plasma to vaporize samples for analysis.[113]
A more area-selective method is electron energy loss spectroscopy, which measures the energy loss of an electron beam within a transmission electron microscope when it interacts with a portion of a sample. The atom-probe tomograph has sub-nanometer resolution in 3-D and can chemically identify individual atoms using time-of-flight mass spectrometry.[114]
Spectra of excited states can be used to analyze the atomic composition of distant stars. Specific light wavelengths contained in the observed light from stars can be separated out and related to the quantized transitions in free gas atoms. These colors can be replicated using a gas-discharge lamp containing the same element.[115] Helium was discovered in this way in the spectrum of the Sun 23 years before it was found on Earth.[116]
Origin and current state
Atoms form about 4% of the total energy density of the observable universe, with an average density of about 0.25 atoms/m3.[117] Within a galaxy such as the Milky Way, atoms have a much higher concentration, with the density of matter in the interstellar medium (ISM) ranging from 105 to 109 atoms/m3.[118] The Sun is believed to be inside the Local Bubble, a region of highly ionized gas, so the density in the solar neighborhood is only about 103 atoms/m3.[119] Stars form from dense clouds in the ISM, and the evolutionary processes of stars result in the steady enrichment of the ISM with elements more massive than hydrogen and helium. Up to 95% of the Milky Way's atoms are concentrated inside stars and the total mass of atoms forms about 10% of the mass of the galaxy.[120] (The remainder of the mass is an unknown dark matter.)[121]Nucleosynthesis
Main article: Nucleosynthesis
Stable protons and electrons appeared one second after the Big Bang. During the following three minutes, Big Bang nucleosynthesis produced most of the helium, lithium, and deuterium in the universe, and perhaps some of the beryllium and boron.[122][123][124] The first atoms (complete with bound electrons) were theoretically created 380,000 years after the Big Bang—an epoch called recombination, when the expanding universe cooled enough to allow electrons to become attached to nuclei.[125]Since the Big Bang, which produced no carbon, atomic nuclei have been combined in stars through the process of nuclear fusion to produce more of the element helium, and (via the triple alpha process) the sequence of elements from carbon up to iron.[126]
Isotopes such as lithium-6, as well as some beryllium and boron are generated in space through cosmic ray spallation.[127] This occurs when a high-energy proton strikes an atomic nucleus, causing large numbers of nucleons to be ejected.
Elements heavier than iron were produced in supernovae through the r-process and in AGB stars through the s-process, both of which involve the capture of neutrons by atomic nuclei.[128] Elements such as lead formed largely through the radioactive decay of heavier elements.[129]
Earth
Most of the atoms that make up the Earth and its inhabitants were present in their current form in the nebula that collapsed out of a molecular cloud to form the Solar System. The rest are the result of radioactive decay, and their relative proportion can be used to determine the age of the Earth through radiometric dating.[130][131] Most of the helium in the crust of the Earth (about 99% of the helium from gas wells, as shown by its lower abundance of helium-3) is a product of alpha decay.[132]There are a few trace atoms on Earth that were not present at the beginning (i.e., not "primordial"), nor are results of radioactive decay. Carbon-14 is continuously generated by cosmic rays in the atmosphere.[133] Some atoms on Earth have been artificially generated either deliberately or as by-products of nuclear reactors or explosions.[134][135] Of the transuranic elements—those with atomic numbers greater than 92—only plutonium and neptunium occur naturally on Earth.[136][137] Transuranic elements have radioactive lifetimes shorter than the current age of the Earth[138] and thus identifiable quantities of these elements have long since decayed, with the exception of traces of plutonium-244 possibly deposited by cosmic dust.[130] Natural deposits of plutonium and neptunium are produced by neutron capture in uranium ore.[139]
The Earth contains approximately 1.33×1050 atoms.[140] In the planet's atmosphere, small numbers of independent atoms of noble gases exist, such as argon and neon. The remaining 99% of the atmosphere is bound in the form of molecules, including carbon dioxide and diatomic oxygen and nitrogen. At the surface of the Earth, atoms combine to form various compounds, including water, salt, silicates and oxides. Atoms can also combine to create materials that do not consist of discrete molecules, including crystals and liquid or solid metals.[141][142] This atomic matter forms networked arrangements that lack the particular type of small-scale interrupted order associated with molecular matter.[143]
Rare and theoretical forms
While isotopes with atomic numbers higher than lead (82) are known to be radioactive, an "island of stability" has been proposed for some elements with atomic numbers above 103. These superheavy elements may have a nucleus that is relatively stable against radioactive decay.[144] The most likely candidate for a stable superheavy atom, unbihexium, has 126 protons and 184 neutrons.[145]Each particle of matter has a corresponding antimatter particle with the opposite electrical charge. Thus, the positron is a positively charged antielectron and the antiproton is a negatively charged equivalent of a proton. When a matter and corresponding antimatter particle meet, they annihilate each other. Because of this, along with an imbalance between the number of matter and antimatter particles, the latter are rare in the universe. (The first causes of this imbalance are not yet fully understood, although the baryogenesis theories may offer an explanation.) As a result, no antimatter atoms have been discovered in nature.[146][147] However, in 1996, antihydrogen, the antimatter counterpart of hydrogen, was synthesized at the CERN laboratory in Geneva.[148][149]
Other exotic atoms have been created by replacing one of the protons, neutrons or electrons with other particles that have the same charge. For example, an electron can be replaced by a more massive muon, forming a muonic atom. These types of atoms can be used to test the fundamental predictions of physics.[150][151][152]
See also
Notes
- ^ In the case of hydrogen-1, with a single electron and nucleon, the proton is
 ,
or 99.95% of the total atomic mass. All other nuclides (isotopes of
hydrogen and all other elements) have more nucleons than electrons, so
the fraction of mass taken by the nucleus is closer to 100% for all of
these types of atoms, than for hydrogen-1.
,
or 99.95% of the total atomic mass. All other nuclides (isotopes of
hydrogen and all other elements) have more nucleons than electrons, so
the fraction of mass taken by the nucleus is closer to 100% for all of
these types of atoms, than for hydrogen-1. - ^ For more recent updates see Interactive Chart of Nuclides (Brookhaven National Laboratory).
- ^ A carat is 200 milligrams. By definition, carbon-12 has 0.012 kg per mole. The Avogadro constant defines 6×1023 atoms per mole.
References
- ^ Leigh, G. J., ed. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. p. 35. ISBN 0-08-022369-9. "An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements."
- ^ Liddell, Henry George; Scott, Robert. "A Greek-English Lexicon". Perseus Digital Library.
- ^ Liddell, Henry George; Scott, Robert. "ἄτομος". A Greek-English Lexicon. Perseus Digital Library. Retrieved 2010-06-21.
- ^ Haubold, Hans; Mathai, A.M. (1998). "Microcosmos: From Leucippus to Yukawa". Structure of the Universe. Retrieved 2008-01-17.
- ^ Harrison 2003, pp. 123–139.
- ^ Leon M. Lederman and Dick Teresi (1993, reprint in 2006). The God Particle: If the Universe is the Answer, What is the Question?. Boston: Houghton Mifflin Company. ISBN 0-61871-168-6. Lederman provides an excellent discussion of this point, and this debate.
- ^ "Radioactive Decays". Stanford Linear Accelerator Center. 15 June 2009. Archived from the original on 7 June 2009. Retrieved 2009-07-04.
- ^ a b Ponomarev 1993, pp. 14–15.
- ^ McEvilley 2002, p. 317.
- ^ King 1999, pp. 105–107.
- ^ Moran 2005, p. 146.
- ^ a b Levere 2001, p. 7.
- ^ Pratt, Vernon (September 28, 2007). "The Mechanical Philosophy". Reason, nature and the human being in the West. Retrieved 2009-06-28.
- ^ Siegfried 2002, pp. 42–55.
- ^ Kemerling, Garth (August 8, 2002). "Corpuscularianism". Philosophical Dictionary. Retrieved 2009-06-17.
- ^ "Lavoisier's Elements of Chemistry". Elements and Atoms. Le Moyne College, Department of Chemistry. Retrieved 2007-12-18.
- ^ Wurtz 1881, pp. 1–2.
- ^ Dalton 1808.
- ^ Roscoe 1895, pp. 129.
- ^ Einstein, Albert (1905). "Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen" (in German) (PDF). Annalen der Physik 322 (8): 549–560. Bibcode 1905AnP...322..549E. doi:10.1002/andp.19053220806. Retrieved 2007-02-04.
- ^ Mazo 2002, pp. 1–7.
- ^ Lee, Y.K.; Hoon, K. (1995). "Brownian Motion". Imperial College. Archived from the original on 18 December 2007. Retrieved 2007-12-18.
- ^ Patterson, G. (2007). "Jean Perrin and the triumph of the atomic doctrine". Endeavour 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003. PMID 17602746.
- ^ "Periodic Table of the Elements". The International Union of Pure and Applied Chemistry. November 1, 2007. Archived from the original on 2010-04-25. Retrieved 2010-05-14.
- ^ Scerri 2007, pp. 10–17.
- ^ "J.J. Thomson". Nobel Foundation. 1906. Retrieved 2007-12-20.
- ^ Rutherford, E. (1911). "The Scattering of α and β Particles by Matter and the Structure of the Atom". Philosophical Magazine 21: 669–88.
- ^ "Frederick Soddy, The Nobel Prize in Chemistry 1921". Nobel Foundation. Retrieved 2008-01-18.
- ^ Thomson, Joseph John (1913). "Rays of positive electricity". Proceedings of the Royal Society. A 89 (607): 1–20. Bibcode 1913RSPSA..89....1T. doi:10.1098/rspa.1913.0057.
- ^ Stern, David P. (May 16, 2005). "The Atomic Nucleus and Bohr's Early Model of the Atom". NASA/Goddard Space Flight Center. Retrieved 2007-12-20.
- ^ Bohr, Niels (11 December 1922). "Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture". Nobel Foundation. Retrieved 2008-02-16.
- ^ Pais 1986, pp. 228–230.
- ^ Lewis, Gilbert N. (1916). "The Atom and the Molecule". Journal of the American Chemical Society 38 (4): 762–786. doi:10.1021/ja02261a002.
- ^ Scerri 2007, pp. 205–226.
- ^ Langmuir, Irving (1919). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society 41 (6): 868–934. doi:10.1021/ja02227a002.
- ^ Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (1987). "On the theory of the Stern-Gerlach apparatus". Foundations of Physics 17 (6): 575–583. Bibcode 1987FoPh...17..575S. doi:10.1007/BF01882788.
- ^ Brown, Kevin (2007). "The Hydrogen Atom". MathPages. Retrieved 2007-12-21.
- ^ Harrison, David M. (2000). "The Development of Quantum Mechanics". University of Toronto. Archived from the original on 25 December 2007. Retrieved 2007-12-21.
- ^ Aston, Francis W. (1920). "The constitution of atmospheric neon". Philosophical Magazine 39 (6): 449–55.
- ^ Chadwick, James (December 12, 1935). "Nobel Lecture: The Neutron and Its Properties". Nobel Foundation. Retrieved 2007-12-21.
- ^ "Otto Hahn, Lise Meitner and Fritz Strassmann". Chemical Achievers: The Human Face of the Chemical Sciences. Chemical Heritage Foundation. Archived from the original on 24 October 2009. Retrieved 2009-09-15.
- ^ Meitner, Lise; Frisch, Otto Robert (1939). "Disintegration of uranium by neutrons: a new type of nuclear reaction". Nature 143 (3615): 239. Bibcode 1939Natur.143..239M. doi:10.1038/143239a0.
- ^ Schroeder, M.. "Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages" (in German). Retrieved 2009-06-04.
- ^ Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997). "A Nobel tale of postwar injustice". Physics Today 50 (9): 26–32. Bibcode 1997PhT....50i..26C. doi:10.1063/1.881933.
- ^ Kullander, Sven (August 28, 2001). "Accelerators and Nobel Laureates". Nobel Foundation. Retrieved 2008-01-31.
- ^ "The Nobel Prize in Physics 1990". Nobel Foundation. October 17, 1990. Retrieved 2008-01-31.
- ^ Demtröder 2002, pp. 39–42.
- ^ Woan 2000, p. 8.
- ^ MacGregor 1992, pp. 33–37.
- ^ a b Particle Data Group (2002). "The Particle Adventure". Lawrence Berkeley Laboratory. Archived from the original on 4 January 2007. Retrieved 2007-01-03.
- ^ a b Schombert, James (April 18, 2006). "Elementary Particles". University of Oregon. Retrieved 2007-01-03.
- ^ Jevremovic 2005, p. 63.
- ^ Pfeffer 2000, pp. 330–336.
- ^ Wenner, Jennifer M. (October 10, 2007). "How Does Radioactive Decay Work?". Carleton College. Retrieved 2008-01-09.
- ^ a b c Raymond, David (April 7, 2006). "Nuclear Binding Energies". New Mexico Tech. Archived from the original on December 11, 2006. Retrieved 2007-01-03.
- ^ Mihos, Chris (July 23, 2002). "Overcoming the Coulomb Barrier". Case Western Reserve University. Retrieved 2008-02-13.
- ^ Staff (March 30, 2007). "ABC's of Nuclear Science". Lawrence Berkeley National Laboratory. Archived from the original on 5 December 2006. Retrieved 2007-01-03.
- ^ Makhijani, Arjun; Saleska, Scott (March 2, 2001). "Basics of Nuclear Physics and Fission". Institute for Energy and Environmental Research. Archived from the original on 16 January 2007. Retrieved 2007-01-03.
- ^ Shultis & Faw 2002, pp. 10–17.
- ^ Fewell, M. P. (1995). "The atomic nuclide with the highest mean binding energy". American Journal of Physics 63 (7): 653–658. Bibcode 1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ Mulliken, Robert S. (1967). "Spectroscopy, Molecular Orbitals, and Chemical Bonding". Science 157 (3784): 13–24. Bibcode 1967Sci...157...13M. doi:10.1126/science.157.3784.13. PMID 5338306.
- ^ a b Brucat, Philip J. (2008). "The Quantum Atom". University of Florida. Archived from the original on 7 December 2006. Retrieved 2007-01-04.
- ^ Manthey, David (2001). "Atomic Orbitals". Orbital Central. Archived from the original on 10 January 2008. Retrieved 2008-01-21.
- ^ Herter, Terry (2006). "Lecture 8: The Hydrogen Atom". Cornell University. Retrieved 2008-02-14.
- ^ Bell, R. E.; Elliott, L. G. (1950). "Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron". Physical Review 79 (2): 282–285. Bibcode 1950PhRv...79..282B. doi:10.1103/PhysRev.79.282.
- ^ Smirnov 2003, pp. 249–272.
- ^ Matis, Howard S. (August 9, 2000). "The Isotopes of Hydrogen". Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab. Archived from the original on 18 December 2007. Retrieved 2007-12-21.
- ^ Weiss, Rick (October 17, 2006). "Scientists Announce Creation of Atomic Element, the Heaviest Yet". Washington Post. Retrieved 2007-12-21.
- ^ a b Sills 2003, pp. 131–134.
- ^ Dumé, Belle (April 23, 2003). "Bismuth breaks half-life record for alpha decay". Physics World. Archived from the original on 14 December 2007. Retrieved 2007-12-21.
- ^ Lindsay, Don (July 30, 2000). "Radioactives Missing From The Earth". Don Lindsay Archive. Archived from the original on 28 April 2007. Retrieved 2007-05-23.
- ^ Tuli, Jagdish K. (April 2005). "Nuclear Wallet Cards". National Nuclear Data Center, Brookhaven National Laboratory. Retrieved 2011-04-16.
- ^ a b CRC Handbook (2002).
- ^ a b Mills et al. (1993).
- ^ Chieh, Chung (January 22, 2001). "Nuclide Stability". University of Waterloo. Retrieved 2007-01-04.
- ^ "Atomic Weights and Isotopic Compositions for All Elements". National Institute of Standards and Technology. Archived from the original on 31 December 2006. Retrieved 2007-01-04.
- ^ Audi, G. (2003). "The Ame2003 atomic mass evaluation (II)". Nuclear Physics A 729 (1): 337–676. Bibcode 2003NuPhA.729..337A. doi:10.1016/j.nuclphysa.2003.11.003. Retrieved 2008-02-07.
- ^ Shannon, R. D. (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallographica A 32 (5): 751. Bibcode 1976AcCrA..32..751S. doi:10.1107/S0567739476001551.
- ^ Dong, Judy (1998). "Diameter of an Atom". The Physics Factbook. Archived from the original on 4 November 2007. Retrieved 2007-11-19.
- ^ Zumdahl (2002).
- ^ Bethe, H. (1929). "Termaufspaltung in Kristallen". Annalen der Physik, 5. Folge 3: 133.
- ^ Birkholz, M.; Rudert, R. (2008). "Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions". Physica status solidi b 245 (9): 1858. Bibcode 2008PSSBR.245.1858B. doi:10.1002/pssb.200879532.
- ^ Staff (2007). "Small Miracles: Harnessing nanotechnology". Oregon State University. Retrieved 2007-01-07.—describes the width of a human hair as 105 nm and 10 carbon atoms as spanning 1 nm.
- ^ Padilla et al. (2002:32)—"There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen."
- ^ Feynman 1995, p. 5.
- ^ a b "Radioactivity". Splung.com. Archived from the original on 4 December 2007. Retrieved 2007-12-19.
- ^ L'Annunziata 2003, pp. 3–56.
- ^ Firestone, Richard B. (May 22, 2000). "Radioactive Decay Modes". Berkeley Laboratory. Retrieved 2007-01-07.
- ^ Hornak, J. P. (2006). "Chapter 3: Spin Physics". The Basics of NMR. Rochester Institute of Technology. Archived from the original on 3 February 2007. Retrieved 2007-01-07.
- ^ a b Schroeder, Paul A. (February 25, 2000). "Magnetic Properties". University of Georgia. Archived from the original on 2007-04-29. Retrieved 2007-01-07.
- ^ Goebel, Greg (September 1, 2007). "[4.3] Magnetic Properties of the Atom". Elementary Quantum Physics. In The Public Domain website. Retrieved 2007-01-07.
- ^ Yarris, Lynn (Spring 1997). "Talking Pictures". Berkeley Lab Research Review. Archived from the original on 13 January 2008. Retrieved 2008-01-09.
- ^ Liang & Haacke 1999, pp. 412–426.
- ^ Zeghbroeck, Bart J. Van (1998). "Energy levels". Shippensburg University. Archived from the original on January 15, 2005. Retrieved 2007-12-23.
- ^ Fowles (1989:227–233).
- ^ Martin, W. C.; Wiese, W. L. (May 2007). "Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas". National Institute of Standards and Technology. Archived from the original on 8 February 2007. Retrieved 2007-01-08.
- ^ "Atomic Emission Spectra — Origin of Spectral Lines". Avogadro Web Site. Retrieved 2006-08-10.
- ^ Fitzpatrick, Richard (February 16, 2007). "Fine structure". University of Texas at Austin. Retrieved 2008-02-14.
- ^ Weiss, Michael (2001). "The Zeeman Effect". University of California-Riverside. Archived from the original on 2 February 2008. Retrieved 2008-02-06.
- ^ Beyer 2003, pp. 232–236.
- ^ Watkins, Thayer. "Coherence in Stimulated Emission". San José State University. Archived from the original on 12 January 2008. Retrieved 2007-12-23.
- ^ Reusch, William (July 16, 2007). "Virtual Textbook of Organic Chemistry". Michigan State University. Retrieved 2008-01-11.
- ^ "Covalent bonding – Single bonds". chemguide. 2000.
- ^ Husted, Robert; et al (December 11, 2003). "Periodic Table of the Elements". Los Alamos National Laboratory. Archived from the original on 10 January 2008. Retrieved 2008-01-11.
- ^ Baum, Rudy (2003). "It's Elemental: The Periodic Table". Chemical & Engineering News. Retrieved 2008-01-11.
- ^ Goodstein 2002, pp. 436–438.
- ^ Brazhkin, Vadim V. (2006). "Metastable phases, phase transformations, and phase diagrams in physics and chemistry". Physics-Uspekhi 49 (7): 719–24. Bibcode 2006PhyU...49..719B. doi:10.1070/PU2006v049n07ABEH006013.
- ^ Myers 2003, p. 85.
- ^ Staff (October 9, 2001). "Bose-Einstein Condensate: A New Form of Matter". National Institute of Standards and Technology. Archived from the original on 3 January 2008. Retrieved 2008-01-16.
- ^ Colton, Imogen; Fyffe, Jeanette (February 3, 1999). "Super Atoms from Bose-Einstein Condensation". The University of Melbourne. Archived from the original on August 29, 2007. Retrieved 2008-02-06.
- ^ Jacox, Marilyn; Gadzuk, J. William (November 1997). "Scanning Tunneling Microscope". National Institute of Standards and Technology. Archived from the original on 7 January 2008. Retrieved 2008-01-11.
- ^ "The Nobel Prize in Physics 1986". The Nobel Foundation. Retrieved 2008-01-11.—in particular, see the Nobel lecture by G. Binnig and H. Rohrer.
- ^ Jakubowski, N. (1998). "Sector field mass spectrometers in ICP-MS". Spectrochimica Acta Part B: Atomic Spectroscopy 53 (13): 1739–63. Bibcode 1998AcSpe..53.1739J. doi:10.1016/S0584-8547(98)00222-5.
- ^ Müller, Erwin W.; Panitz, John A.; McLane, S. Brooks (1968). "The Atom-Probe Field Ion Microscope". Review of Scientific Instruments 39 (1): 83–86. Bibcode 1968RScI...39...83M. doi:10.1063/1.1683116.
- ^ Lochner, Jim; Gibb, Meredith; Newman, Phil (April 30, 2007). "What Do Spectra Tell Us?". NASA/Goddard Space Flight Center. Archived from the original on 16 January 2008. Retrieved 2008-01-03.
- ^ Winter, Mark (2007). "Helium". WebElements. Archived from the original on 30 December 2007. Retrieved 2008-01-03.
- ^ Hinshaw, Gary (February 10, 2006). "What is the Universe Made Of?". NASA/WMAP. Archived from the original on 31 December 2007. Retrieved 2008-01-07.
- ^ Choppin, Liljenzin & Rydberg 2001, p. 441.
- ^ Davidsen, Arthur F. (1993). "Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission". Science 259 (5093): 327–34. Bibcode 1993Sci...259..327D. doi:10.1126/science.259.5093.327. PMID 17832344.
- ^ Lequeux 2005, p. 4.
- ^ Smith, Nigel (January 6, 2000). "The search for dark matter". Physics World. Archived from the original on 16 February 2008. Retrieved 2008-02-14.
- ^ Croswell, Ken (1991). "Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium". New Scientist (1794): 42. Archived from the original on 7 February 2008. Retrieved 2008-01-14.
- ^ Copi, Craig J.; Schramm, DN; Turner, MS (1995). "Big-Bang Nucleosynthesis and the Baryon Density of the Universe". Science 267 (5195): 192–99. arXiv:astro-ph/9407006. Bibcode 1995Sci...267..192C. doi:10.1126/science.7809624. PMID 7809624.
- ^ Hinshaw, Gary (December 15, 2005). "Tests of the Big Bang: The Light Elements". NASA/WMAP. Archived from the original on 17 January 2008. Retrieved 2008-01-13.
- ^ Abbott, Brian (May 30, 2007). "Microwave (WMAP) All-Sky Survey". Hayden Planetarium. Retrieved 2008-01-13.
- ^ Hoyle, F. (1946). "The synthesis of the elements from hydrogen". Monthly Notices of the Royal Astronomical Society 106: 343–83. Bibcode 1946MNRAS.106..343H.
- ^ Knauth, D. C.; Knauth, D. C.; Lambert, David L.; Crane, P. (2000). "Newly synthesized lithium in the interstellar medium". Nature 405 (6787): 656–58. doi:10.1038/35015028. PMID 10864316.
- ^ Mashnik, Stepan G. (2000). "On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes". arXiv:astro-ph/0008382 [astro-ph].
- ^ Kansas Geological Survey (May 4, 2005). "Age of the Earth". University of Kansas. Retrieved 2008-01-14.
- ^ a b Manuel 2001, pp. 407–430,511–519.
- ^ Dalrymple, G. Brent (2001). "The age of the Earth in the twentieth century: a problem (mostly) solved". Geological Society, London, Special Publications 190 (1): 205–21. Bibcode 2001GSLSP.190..205D. doi:10.1144/GSL.SP.2001.190.01.14. Retrieved 2008-01-14.
- ^ Anderson, Don L.; Foulger, G. R.; Meibom, Anders (September 2, 2006). "Helium: Fundamental models". MantlePlumes.org. Archived from the original on 8 February 2007. Retrieved 2007-01-14.
- ^ Pennicott, Katie (May 10, 2001). "Carbon clock could show the wrong time". PhysicsWeb. Archived from the original on 15 December 2007. Retrieved 2008-01-14.
- ^ Yarris, Lynn (July 27, 2001). "New Superheavy Elements 118 and 116 Discovered at Berkeley Lab". Berkeley Lab. Archived from the original on 9 January 2008. Retrieved 2008-01-14.
- ^ Diamond, H; et al. (1960). "Heavy Isotope Abundances in Mike Thermonuclear Device". Physical Review 119 (6): 2000–04. Bibcode 1960PhRv..119.2000D. doi:10.1103/PhysRev.119.2000.
- ^ Poston Sr., John W. (March 23, 1998). "Do transuranic elements such as plutonium ever occur naturally?". Scientific American. Retrieved 2008-01-15.
- ^ Keller, C. (1973). "Natural occurrence of lanthanides, actinides, and superheavy elements". Chemiker Zeitung 97 (10): 522–30. OSTI 4353086.
- ^ Zaider & Rossi 2001, p. 17.
- ^ "Oklo Fossil Reactors". Curtin University of Technology. Archived from the original on 18 December 2007. Retrieved 2008-01-15.
- ^ Weisenberger, Drew. "How many atoms are there in the world?". Jefferson Lab. Retrieved 2008-01-16.
- ^ Pidwirny, Michael. "Fundamentals of Physical Geography". University of British Columbia Okanagan. Archived from the original on 21 January 2008. Retrieved 2008-01-16.
- ^ Anderson, Don L. (2002). "The inner inner core of Earth". Proceedings of the National Academy of Sciences 99 (22): 13966–68. Bibcode 2002PNAS...9913966A. doi:10.1073/pnas.232565899. PMC 137819. PMID 12391308.
- ^ Pauling 1960, pp. 5–10.
- ^ Anonymous (October 2, 2001). "Second postcard from the island of stability". CERN Courier. Archived from the original on 3 February 2008. Retrieved 2008-01-14.
- ^ Jacoby, Mitch (2006). "As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine". Chemical & Engineering News 84 (10): 19.
- ^ Koppes, Steve (March 1, 1999). "Fermilab Physicists Find New Matter-Antimatter Asymmetry". University of Chicago. Retrieved 2008-01-14.
- ^ Cromie, William J. (August 16, 2001). "A lifetime of trillionths of a second: Scientists explore antimatter". Harvard University Gazette. Retrieved 2008-01-14.
- ^ Hijmans, Tom W. (2002). "Particle physics: Cold antihydrogen". Nature 419 (6906): 439–40. doi:10.1038/419439a. PMID 12368837.
- ^ Staff (October 30, 2002). "Researchers 'look inside' antimatter". BBC News. Retrieved 2008-01-14.
- ^ Barrett, Roger (1990). "The Strange World of the Exotic Atom". New Scientist (1728): 77–115. Archived from the original on 21 December 2007. Retrieved 2008-01-04.
- ^ Indelicato, Paul (2004). "Exotic Atoms". Physica Scripta T112 (1): 20–26. arXiv:physics/0409058. Bibcode 2004PhST..112...20I. doi:10.1238/Physica.Topical.112a00020.
- ^ Ripin, Barrett H. (July 1998). "Recent Experiments on Exotic Atoms". American Physical Society. Retrieved 2008-02-15.
Book references
- L'Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. ISBN 0-12-436603-1. OCLC 16212955.
- Beyer, H. F.; Shevelko, V. P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. ISBN 0-7503-0481-2. OCLC 47150433.
- Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan (2001). Radiochemistry and Nuclear Chemistry. Elsevier. ISBN 0-7506-7463-6. OCLC 162592180.
- Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell.
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st ed.). Springer. ISBN 3-540-20631-0. OCLC 181435713.
- Feynman, Richard (1995). Six Easy Pieces. The Penguin Group. ISBN 978-0-14-027666-4. OCLC 40499574.
- Fowles, Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. ISBN 0-486-65957-7. OCLC 18834711.
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 0-391-02177-X. OCLC 10916778.
- Goodstein, David L. (2002). States of Matter. Courier Dover Publications. ISBN 0-13-843557-X.
- Harrison, Edward Robert (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. Cambridge University Press. ISBN 0-521-77351-2. OCLC 50441595.
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. Routledge. ISBN 0-415-17995-5. OCLC 44541769.
- Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. ISBN 0-387-23284-2. OCLC 228384008.
- King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 0-7486-0954-7.
- Lequeux, James (2005). The Interstellar Medium. Springer. ISBN 3-540-21326-0. OCLC 133157789.
- Levere, Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. The Johns Hopkins University Press. ISBN 0-8018-6610-3.
- Liang, Z.-P.; Haacke, E. M. (1999). Webster, J. G.. ed (PDF). Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. vol. 2. John Wiley & Sons. pp. 412–26. ISBN 0-471-13946-7. Retrieved 2008-01-09.
- McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 1-58115-203-5.
- MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. ISBN 0-19-521833-7. OCLC 223372888.
- Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 0-306-46562-0. OCLC 228374906.
- Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. ISBN 0-19-851567-7. OCLC 48753074.
- Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2nd ed.). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. ISBN 0-632-03583-8. OCLC 27011505.
- Moran, Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. Harvard University Press. ISBN 0-674-01495-2.
- Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. ISBN 0-313-31664-3. OCLC 50164580.
- Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc.. ISBN 0-13-054091-9. OCLC 47925884.
- Pais, Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. ISBN 0-19-851971-0.
- Pauling, Linus (1960). The Nature of the Chemical Bond. Cornell University Press. ISBN 0-8014-0333-2. OCLC 17518275.
- Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. ISBN 1-86094-250-4. OCLC 45900880.
- Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. CRC Press. ISBN 0-7503-0251-8. OCLC 26853108.
- Roscoe, Henry Enfield (1895). John Dalton and the Rise of Modern Chemistry. Century science series. New York: Macmillan. Retrieved 2011-04-03.
- Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. ISBN 0-19-530573-6.
- Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. ISBN 0-8247-0834-2. OCLC 123346507.
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 0-87169-924-9. OCLC 186607849.
- Sills, Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. ISBN 0-7641-2146-4. OCLC 51543743.
- Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. ISBN 0-387-95550-X.
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. pp. 213–214. ISBN 0-7432-4379-X.
- Various (2002). Lide, David R.. ed. Handbook of Chemistry & Physics (88th ed.). CRC. ISBN 0-8493-0486-5. OCLC 179976746. Archived from the original on 23 May 2008. Retrieved 2008-05-23.
- Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. ISBN 0-521-57507-9. OCLC 224032426.
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 0-559-43636-X.
- Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. ISBN 0-306-46403-9. OCLC 44110319.
- Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (5th ed.). Houghton Mifflin. ISBN 0-618-34342-3. OCLC 173081482. Archived from the original on 4 March 2008. Retrieved 2008-02-05.
| Atom helium | ||||||||
|---|---|---|---|---|---|---|---|---|
| Ilustrasi atom helium yang memperlihatkan inti atom (merah muda) dan distribusi awan elektron (hitam). Inti atom (kanan atas) berbentuk simetris bulat, walaupun untuk inti atom yang lebih rumit ia tidaklah selalu demikian. | ||||||||
| Klasifikasi | ||||||||
|
||||||||
| Sifat-sifat | ||||||||
|
Istilah atom berasal dari Bahasa Yunani (ἄτομος/átomos, α-τεμνω), yang berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat dibagi-bagi lagi. Konsep atom sebagai komponen yang tak dapat dibagi-bagi lagi pertama kali diajukan oleh para filsuf India dan Yunani. Pada abad ke-17 dan ke-18, para kimiawan meletakkan dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat tertentu tidak dapat dibagi-bagi lebih jauh lagi menggunakan metode-metode kimia. Selama akhir abad ke-19 dan awal abad ke-20, para fisikawan berhasil menemukan struktur dan komponen-komponen subatom di dalam atom, membuktikan bahwa 'atom' tidaklah tak dapat dibagi-bagi lagi. Prinsip-prinsip mekanika kuantum yang digunakan para fisikawan kemudian berhasil memodelkan atom.[1]
Dalam pengamatan sehari-hari, secara relatif atom dianggap sebuah objek yang sangat kecil yang memiliki massa yang secara proporsional kecil pula. Atom hanya dapat dipantau dengan menggunakan peralatan khusus seperti mikroskop gaya atom. Lebih dari 99,9% massa atom berpusat pada inti atom,[catatan 1] dengan proton dan neutron yang bermassa hampir sama. Setiap unsur paling tidak memiliki satu isotop dengan inti yang tidak stabil, yang dapat mengalami peluruhan radioaktif. Hal ini dapat mengakibatkan transmutasi, yang mengubah jumlah proton dan neutron pada inti.[2] Elektron yang terikat pada atom mengandung sejumlah aras energi, ataupun orbital, yang stabil dan dapat mengalami transisi di antara aras tersebut dengan menyerap ataupun memancarkan foton yang sesuai dengan perbedaan energi antara aras. Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur, dan memengaruhi sifat-sifat magnetis atom tersebut.
Daftar isi |
Sejarah
Konsep bahwa materi terdiri dari satuan-satuan terpisah yang tidak dapat dibagi lagi menjadi satuan yang lebih kecil telah ada selama satu milenium. Namun, pemikiran tersebut masihlah bersifat abstrak dan filosofis, daripada berdasarkan pengamatan empiris dan eksperimen. Secara filosofis, deskripsi sifat-sifat atom bervariasi tergantung pada budaya dan aliran filosofi tersebut, dan seringkali pula mengandung unsur-unsur spiritual di dalamnya. Walaupun demikian, pemikiran dasar mengenai atom dapat diterima oleh para ilmuwan ribuan tahun kemudian, karena ia secara elegan dapat menjelaskan penemuan-penemuan baru pada bidang kimia.[3]Rujukan paling awal mengenai konsep atom dapat ditilik kembali kepada zaman India kuno pada tahun 800 sebelum masehi,[4] yang dijelaskan dalam naskah filsafat Jainisme sebagai anu dan paramanu.[4][5] Aliran mazhab Nyaya dan Vaisesika mengembangkan teori yang menjelaskan bagaimana atom-atom bergabung menjadi benda-benda yang lebih kompleks.[6] Satu abad kemudian muncul rujukan mengenai atom di dunia Barat oleh Leukippos, yang kemudian oleh muridnya Demokritos pandangan tersebut disistematiskan. Kira-kira pada tahun 450 SM, Demokritos menciptakan istilah átomos (bahasa Yunani: ἄτομος), yang berarti "tidak dapat dipotong" ataupun "tidak dapat dibagi-bagi lagi". Teori Demokritos mengenai atom bukanlah usaha untuk menjabarkan suatu fenomena fisis secara rinci, melainkan suatu filosofi yang mencoba untuk memberikan jawaban atas perubahan-perubahan yang terjadi pada alam.[1] Filosofi serupa juga terjadi di India, namun demikian ilmu pengetahuan modern memutuskan untuk menggunakan istilah "atom" yang dicetuskan oleh Demokritos.[3]
Kemajuan lebih jauh pada pemahaman mengenai atom dimulai dengan berkembangnya ilmu kimia. Pada tahun 1661, Robert Boyle mempublikasikan buku The Sceptical Chymist yang berargumen bahwa materi-materi di dunia ini terdiri dari berbagai kombinasi "corpuscules", yaitu atom-atom yang berbeda. Hal ini berbeda dengan pandangan klasik yang berpendapat bahwa materi terdiri dari unsur-unsur udara, tanah, api, dan air.[7] Pada tahun 1789, istilah element (unsur) didefinisikan oleh seorang bangsawan dan peneliti Perancis, Antoine Lavoisier, sebagai bahan dasar yang tidak dapat dibagi-bagi lebih jauh lagi dengan menggunakan metode-metode kimia.[8]

Berbagai atom dan molekul yang digambarkan pada buku John Dalton, A New System of Chemical Philosophy (1808).
Teori partikel ini kemudian dikonfirmasikan lebih jauh lagi pada tahun 1827, yaitu ketika botaniwan Robert Brown menggunakan mikroskop untuk mengamati debu-debu yang mengambang di atas air dan menemukan bahwa debu-debu tersebut bergerak secara acak. Fenomena ini kemudian dikenal sebagai "Gerak Brown". Pada tahun 1877, J. Desaulx mengajukan pendapat bahwa fenomena ini disebabkan oleh gerak termal molekul air, dan pada tahun 1905 Albert Einstein membuat analisis matematika terhadap gerak ini.[11][12][13] Fisikawan Perancis Jean Perrin kemudian menggunakan hasil kerja Einstein untuk menentukan massa dan dimensi atom secara eksperimen, yang kemudian dengan pasti menjadi verifikasi atas teori atom Dalton.[14]
Berdasarkan hasil penelitiannya terhadap sinar katode, pada tahun 1897 J. J. Thomson menemukan elektron dan sifat-sifat subatomiknya. Hal ini meruntuhkan konsep atom sebagai satuan yang tidak dapat dibagi-bagi lagi.[15] Thomson percaya bahwa elektron-elektron terdistribusi secara merata di seluruh atom, dan muatan-muatannya diseimbangkan oleh keberadaan lautan muatan positif (model puding prem).
Namun pada tahun 1909, para peneliti di bawah arahan Ernest Rutherford menembakkan ion helium ke lembaran tipis emas, dan menemukan bahwa sebagian kecil ion tersebut dipantulkan dengan sudut pantulan yang lebih tajam dari yang apa yang diprediksikan oleh teori Thomson. Rutherford kemudian mengajukan pendapat bahwa muatan positif suatu atom dan kebanyakan massanya terkonsentrasi pada inti atom, dengan elektron yang mengitari inti atom seperti planet mengitari matahari. Muatan positif ion helium yang melewati inti padat ini haruslah dipantulkan dengan sudut pantulan yang lebih tajam. Pada tahun 1913, ketika bereksperimen dengan hasil proses peluruhan radioaktif, Frederick Soddy menemukan bahwa terdapat lebih dari satu jenis atom pada setiap posisi tabel periodik.[16] Istilah isotop kemudian diciptakan oleh Margaret Todd sebagai nama yang tepat untuk atom-atom yang berbeda namun merupakan satu unsur yang sama. J.J. Thomson selanjutnya menemukan teknik untuk memisahkan jenis-jenis atom tersebut melalui hasil kerjanya pada gas yang terionisasi.[17]

Model atom hidrogen Bohr yang menunjukkan loncatan elektron antara orbit-orbit tetap dan memancarkan energi foton dengan frekuensi tertentu.
Ikatan kimia antar atom kemudian pada tahun 1916 dijelaskan oleh Gilbert Newton Lewis sebagai interaksi antara elektron-elektron atom tersebut.[20] Atas adanya keteraturan sifat-sifat kimiawi dalam tabel periode kimia,[21] kimiawan Amerika Irving Langmuir tahun 1919 berpendapat bahwa hal ini dapat dijelaskan apabila elektron-elektron pada sebuah atom saling berhubungan atau berkumpul dalam bentuk-bentuk tertentu. Sekelompok elektron diperkirakan menduduki satu set kelopak elektron di sekitar inti atom.
Percobaan Stern-Gerlach pada tahun 1922 memberikan bukti lebih jauh mengenai sifat-sifat kuantum atom. Ketika seberkas atom perak ditembakkan melalui medan magnet, berkas tersebut terpisah-pisah sesuai dengan arah momentum sudut atom (spin). Oleh karena arah spin adalah acak, berkas ini diharapkan menyebar menjadi satu garis. Namun pada kenyataannya berkas ini terbagi menjadi dua bagian, tergantung dari apakah spin atom tersebut berorientasi ke atas ataupun ke bawah.[22]
Pada tahun 1926, dengan menggunakan pemikiran Louis de Broglie bahwa partikel berperilaku seperti gelombang, Erwin Schrödinger mengembangkan suatu model atom matematis yang menggambarkan elektron sebagai gelombang tiga dimensi daripada sebagai titik-titik partikel. Konsekuensi penggunaan bentuk gelombang untuk menjelaskan elektron ini adalah bahwa adalah tidak mungkin untuk secara matematis menghitung posisi dan momentum partikel secara bersamaan. Hal ini kemudian dikenal sebagai prinsip ketidakpastian, yang dirumuskan oleh Werner Heisenberg pada 1926. Menurut konsep ini, untuk setiap pengukuran suatu posisi, seseorang hanya bisa mendapatkan kisaran nilai-nilai probabilitas momentum, demikian pula sebaliknya. Walaupun model ini sulit untuk divisualisasikan, ia dapat dengan baik menjelaskan sifat-sifat atom yang terpantau yang sebelumnya tidak dapat dijelaskan oleh teori mana pun. Oleh sebab itu, model atom yang menggambarkan elektron mengitari inti atom seperti planet mengitari matahari digugurkan dan digantikan oleh model orbital atom di sekitar inti di mana elektron paling berkemungkinan berada.[23][24]
Perkembangan pada spektrometri massa mengijinkan dilakukannya pengukuran massa atom secara tepat. Peralatan spektrometer ini menggunakan magnet untuk membelokkan trayektori berkas ion, dan banyaknya defleksi ditentukan dengan rasio massa atom terhadap muatannya. Kimiawan Francis William Aston menggunakan peralatan ini untuk menunjukkan bahwa isotop mempunyai massa yang berbeda. Perbedaan massa antar isotop ini berupa bilangan bulat, dan ia disebut sebagai kaidah bilangan bulat.[25] Penjelasan pada perbedaan massa isotop ini berhasil dipecahkan setelah ditemukannya neutron, suatu partikel bermuatan netral dengan massa yang hampir sama dengan proton, yaitu oleh James Chadwick pada tahun 1932. Isotop kemudian dijelaskan sebagai unsur dengan jumlah proton yang sama, namun memiliki jumlah neutron yang berbeda dalam inti atom.[26]
Pada tahun 1950-an, perkembangan pemercepat partikel dan detektor partikel mengijinkan para ilmuwan mempelajari dampak-dampak dari atom yang bergerak dengan energi yang tinggi.[27] Neutron dan proton kemudian diketahui sebagai hadron, yaitu komposit partikel-partikel kecil yang disebut sebagai kuark. Model-model standar fisika nuklir kemudian dikembangkan untuk menjelaskan sifat-sifat inti atom dalam hal interaksi partikel subatom ini.[28]
Sekitar tahun 1985, Steven Chu dkk. di Bell Labs mengembangkan sebuah teknik untuk menurunkan temperatur atom menggunakan laser. Pada tahun yang sama, sekelompok ilmuwan yang diketuai oleh William D. Phillips berhasil memerangkap atom natrium dalam perangkap magnet. Claude Cohen-Tannoudji kemudian menggabungkan kedua teknik tersebut untuk mendinginkan sejumlah kecil atom sampai beberapa mikrokelvin. Hal ini mengijinkan ilmuwan mempelajari atom dengan presisi yang sangat tinggi, yang pada akhirnya membawa para ilmuwan menemukan kondensasi Bose-Einstein.[29]
Dalam sejarahnya, sebuah atom tunggal sangatlah kecil untuk digunakan dalam aplikasi ilmiah. Namun baru-baru ini, berbagai peranti yang menggunakan sebuah atom tunggal logam yang dihubungkan dengan ligan-ligan organik (transistor elektron tunggal) telah dibuat.[30] Berbagai penelitian telah dilakukan untuk memerangkap dan memperlambat laju atom menggunakan pendinginan laser untuk mendapatkan pemahaman yang lebih baik mengenai sifat-sifat atom.[31]
Komponen-komponen atom
Partikel subatom
Dari kesemua partikel subatom ini, elektron adalah yang paling ringan, dengan massa elektron sebesar 9,11 × 10−31 kg dan mempunyai muatan negatif. Ukuran elektron sangatlah kecil sedemikiannya tiada teknik pengukuran yang dapat digunakan untuk mengukur ukurannya.[32] Proton memiliki muatan positif dan massa 1.836 kali lebih berat daripada elektron (1,6726 × 10−27 kg). Neutron tidak bermuatan listrik dan bermassa bebas 1.839 kali massa elektron[33] atau (1,6929 × 10−27 kg).
Dalam model standar fisika, baik proton dan neutron terdiri dari partikel elementer yang disebut kuark. Kuark termasuk kedalam golongan partikel fermion dan merupakan salah satu dari dua bahan penyusun materi dasar (yang lainnya adalah lepton). Terdapat enam jenis kuark dan tiap-tiap kuark tersebut memiliki muatan listri fraksional sebesar +2/3 ataupun −1/3. Proton terdiri dari dua kuark naik dan satu kuark turun, manakala neutron terdiri dari satu kuark naik dan dua kuark turun. Perbedaan komposisi kuark ini memengaruhi perbedaan massa dan muatan antara dua partikel tersebut. Kuark terikat bersama oleh gaya nuklir kuat yang diperantarai oleh gluon. Gluon adalah anggota dari boson tolok yang merupakan perantara gaya-gaya fisika.[34][35]
Inti atom

Energi pengikatan yang diperlukan oleh nukleon untuk lolos dari inti pada berbagai isotop.
![\begin{smallmatrix}1,07 \sqrt[3]{A}\end{smallmatrix}](http://upload.wikimedia.org/math/b/5/6/b56e16e37f6036d3414eaf3c1d299f8a.png) fm, dengan A adalah jumlah nukleon.[37]
Hal ini sangatlah kecil dibandingkan dengan jari-jari atom.
Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik
potensial yang disebut gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38]
fm, dengan A adalah jumlah nukleon.[37]
Hal ini sangatlah kecil dibandingkan dengan jari-jari atom.
Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik
potensial yang disebut gaya kuat residual. Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripada gaya elektrostatik yang menyebabkan proton saling tolak menolak.[38]Atom dari unsur kimia yang sama memiliki jumlah proton yang sama, disebut nomor atom. Suatu unsur dapat memiliki jumlah neutron yang bervariasi. Variasi ini disebut sebagai isotop. Jumlah proton dan neutron suatu atom akan menentukan nuklida atom tersebut, sedangkan jumlah neutron relatif terhadap jumlah proton akan menentukan stabilitas inti atom, dengan isotop unsur tertentu akan menjalankan peluruhan radioaktif.[39]
Neutron dan proton adalah dua jenis fermion yang berbeda. Asas pengecualian Pauli melarang adanya keberadaan fermion yang identik (seperti misalnya proton berganda) menduduki suatu keadaan fisik kuantum yang sama pada waktu yang sama. Oleh karena itu, setiap proton dalam inti atom harusnya menduduki keadaan kuantum yang berbeda dengan aras energinya masing-masing. Asas Pauli ini juga berlaku untuk neutron. Pelarangan ini tidak berlaku bagi proton dan neutron yang menduduki keadaan kuantum yang sama.[40]
Untuk atom dengan nomor atom yang rendah, inti atom yang memiliki jumlah proton lebih banyak daripada neutron berpotensi jatuh ke keadaan energi yang lebih rendah melalui peluruhan radioaktif yang menyebabkan jumlah proton dan neutron seimbang. Oleh karena itu, atom dengan jumlah proton dan neutron yang berimbang lebih stabil dan cenderung tidak meluruh. Namun, dengan meningkatnya nomor atom, gaya tolak-menolak antar proton membuat inti atom memerlukan proporsi neutron yang lebih tinggi lagi untuk menjaga stabilitasnya. Pada inti yang paling berat, rasio neutron per proton yang diperlukan untuk menjaga stabilitasnya akan meningkat menjadi 1,5.[40]
Jika massa inti setelah terjadinya reaksi fusi lebih kecil daripada jumlah massa partikel awal penyusunnya, maka perbedaan ini disebabkan oleh pelepasan pancaran energi (misalnya sinar gamma), sebagaimana yang ditemukan pada rumus kesetaraan massa-energi Einstein, E = mc2, dengan m adalah massa yang hilang dan c adalah kecepatan cahaya. Defisit ini merupakan bagian dari energi pengikatan inti yang baru.[44]
Fusi dua inti yang menghasilkan inti yang lebih besar dengan nomor atom lebih rendah daripada besi dan nikel (jumlah total nukleon sama dengan 60) biasanya bersifat eksotermik, yang berarti bahwa proses ini melepaskan energi.[45] Adalah proses pelepasan energi inilah yang membuat fusi nuklir pada bintang dapat dipertahankan. Untuk inti yang lebih berat, energi pengikatan per nukleon dalam inti mulai menurun. Ini berarti bahwa proses fusi akan bersifat endotermik.[40]
Awan elektron
Elektron, sama seperti partikel lainnya, memiliki sifat seperti partikel maupun seperti gelombang (dualisme gelombang-partikel). Awan elektron adalah suatu daerah dalam sumur potensi di mana tiap-tiap elektron menghasilkan sejenis gelombang diam (yaitu gelombang yang tidak bergerak relatif terhadap inti) tiga dimensi. Perilaku ini ditentukan oleh orbital atom, yakni suatu fungsi matematika yang menghitung probabilitas suatu elektron akan muncul pada suatu lokasi tertentu ketika posisinya diukur.[46] Hanya akan ada satu himpunan orbital tertentu yang berada disekitar inti, karena pola-pola gelombang lainnya akan dengan cepat meluruh menjadi bentuk yang lebih stabil.[47]
Energi yang diperlukan untuk melepaskan ataupun menambah satu elektron (energi pengikatan elektron) adalah lebih kecil daripada energi pengikatan nukleon. Sebagai contohnya, hanya diperlukan 13,6 eV untuk melepaskan elektron dari atom hidrogen.[48] Bandingkan dengan energi sebesar 2,3 MeV yang diperlukan untuk memecah inti deuterium.[49] Atom bermuatan listrik netral oleh karena jumlah proton dan elektronnya yang sama. Atom yang kekurangan ataupun kelebihan elektron disebut sebagai ion. Elektron yang terletak paling luar dari inti dapat ditransfer ataupun dibagi ke atom terdekat lainnya. Dengan cara inilah, atom dapat saling berikatan membentuk molekul.[50]
Sifat-sifat
Sifat-sifat nuklir
Berdasarkan definisi, dua atom dengan jumlah proton yang identik dalam intinya termasuk ke dalam unsur kimia yang sama. Atom dengan jumlah proton sama namun dengan jumlah neutron berbeda adalah dua isotop berbeda dari satu unsur yang sama. Sebagai contohnya, semua hidrogen memiliki satu proton, namun terdapat satu isotop hidrogen yang tidak memiliki neutron (hidrogen-1), satu isotop yang memiliki satu neutron (deuterium), dua neutron (tritium), dll. Hidrogen-1 adalah bentuk isotop hidrogen yang paling umum. Kadang-kadang ia disebut sebagai protium.[51] Semua isotop unsur yang bernomor atom lebih besar daripada 82 bersifat radioaktif.[52][53]Dari sekitar 339 nuklida yang terbentuk secara alami di Bumi, 269 di antaranya belum pernah terpantau meluruh.[54] Pada unsur kimia, 80 dari unsur yang diketahui memiliki satu atau lebih isotop stabil. Unsur 43, 63, dan semua unsur lebih tinggi dari 83 tidak memiliki isotop stabil. Dua puluh tujuh unsur hanya memiliki satu isotop stabil, manakala jumlah isotop stabil yang paling banyak terpantau pada unsur timah dengan 10 jenis isotop stabil.[55]
Massa
Karena mayoritas massa atom berasal dari proton dan neutron, jumlah keseluruhan partikel ini dalam atom disebut sebagai nomor massa. Massa atom pada keadaan diam sering diekspresikan menggunakan satuan massa atom (u) yang juga disebut dalton (Da). Satuan ini didefinisikan sebagai seperduabelas massa atom karbon-12 netral, yang kira-kira sebesar 1,66 × 10−27 kg.[56] Hidrogen-1 yang merupakan isotop teringan hidrogen memiliki bobot atom 1,007825 u.[57] Atom memiliki massa yang kira-kira sama dengan nomor massanya dikalikan satuan massa atom.[58] Atom stabil yang paling berat adalah timbal-208,[52] dengan massa sebesar 207,9766521 u.[59]Para kimiawan biasanya menggunakan satuan mol untuk menyatakan jumlah atom. Satu mol didefinisikan sebagai jumlah atom yang terdapat pada 12 gram persis karbon-12. Jumlah ini adalah sekitar 6,022 × 1023, yang dikenal pula dengan nama tetapan Avogadro. Dengan demikian suatu unsur dengan massa atom 1 u akan memiliki satu mol atom yang bermassa 0,001 kg. Sebagai contohnya, Karbon memiliki massa atom 12 u, sehingga satu mol karbon atom memiliki massa 0,012 kg.[56]
Ukuran
Ukuran atom sangatlah kecil, sedemikian kecilnya lebar satu helai rambut dapat menampung sekitar 1 juta atom karbon.[63] Satu tetes air pula mengandung sekitar 2 × 1021 atom oksigen.[64] Intan satu karat dengan massa 2 × 10-4 kg mengandung sekitar 1022 atom karbon.[catatan 2] Jika sebuah apel diperbesar sampai seukuran besarnya Bumi, maka atom dalam apel tersebut akan terlihat sebesar ukuran apel awal tersebut.[65]
Peluruhan radioaktif
Bentuk-bentuk peluruhan radioaktif yang paling umum adalah:[67][68]
- Peluruhan alfa, terjadi ketika suatu inti memancarkan partikel alfa (inti helium yang terdiri dari dua proton dan dua neutron). Hasil peluruhan ini adalah unsur baru dengan nomor atom yang lebih kecil.
- Peluruhan beta, diatur oleh gaya lemah, dan dihasilkan oleh transformasi neutron menjadi proton, ataupun proton menjadi neutron. Transformasi neutron menjadi proton akan diikuti oleh emisi satu elektron dan satu antineutrino, manakala transformasi proton menjadi neutron diikuti oleh emisi satu positron dan satu neutrino. Emisi elektron ataupun emisi positron disebut sebagai partikel beta. Peluruhan beta dapat meningkatkan maupun menurunkan nomor atom inti sebesar satu.
- Peluruhan gama, dihasilkan oleh perubahan pada aras energi inti ke keadaan yang lebih rendah, menyebabkan emisi radiasi elektromagnetik. Hal ini dapat terjadi setelah emisi partikel alfa ataupun beta dari peluruhan radioaktif.
Tiap-tiap isotop radioaktif mempunyai karakteristik periode waktu peluruhan (waktu paruh) yang merupakan lamanya waktu yang diperlukan oleh setengah jumlah sampel untuk meluruh habis. Proses peluruhan bersifat eksponensial, sehingga setelah dua waktu paruh, hanya akan tersisa 25% isotop.[66]
Momen magnetik
Setiap partikel elementer mempunyai sifat mekanika kuantum intrinsik yang dikenal dengan nama spin. Spin beranalogi dengan momentum sudut suatu objek yang berputar pada pusat massanya, walaupun secara kaku partikel tidaklah berperilaku seperti ini. Spin diukur dalam satuan tetapan Planck tereduksi (ħ), dengan elektron, proton, dan neutron semuanya memiliki spin ½ ħ, atau "spin-½". Dalam atom, elektron yang bergerak di sekitar inti atom selain memiliki spin juga memiliki momentum sudut orbital, manakala inti atom memiliki momentum sudut pula oleh karena spin nuklirnya sendiri.[69]Medan magnet yang dihasilkan oleh suatu atom (disebut momen magnetik) ditentukan oleh kombinasi berbagai macam momentum sudut ini. Namun, kontribusi yang terbesar tetap berasal dari spin. Oleh karena elektron mematuhi asas pengecualian Pauli, yakni tiada dua elektron yang dapat ditemukan pada keadaan kuantum yang sama, pasangan elektron yang terikat satu sama lainnya memiliki spin yang berlawanan, dengan satu berspin naik, dan yang satunya lagi berspin turun. Kedua spin yang berlawanan ini akan saling menetralkan, sehingga momen dipol magnetik totalnya menjadi nol pada beberapa atom berjumlah elektron genap.[70]
Pada atom berelektron ganjil seperti besi, adanya keberadaan elektron yang tak berpasangan menyebabkan atom tersebut bersifat feromagnetik. Orbital-orbital atom di sekeliling atom tersebut saling bertumpang tindih dan penurunan keadaan energi dicapai ketika spin elektron yang tak berpasangan tersusun saling berjajar. Proses ini disebut sebagai interaksi pertukaran. Ketika momen magnetik atom feromagnetik tersusun berjajaran, bahan yang tersusun oleh atom ini dapat menghasilkan medan makroskopis yang dapat dideteksi. Bahan-bahan yang bersifat paramagnetik memiliki atom dengan momen magnetik yang tersusun acak, sehingga tiada medan magnet yang dihasilkan. Namun, momen magnetik tiap-tiap atom individu tersebut akan tersusun berjajar ketika diberikan medan magnet.[70][71]
Inti atom juga dapat memiliki spin. Biasanya spin inti tersusun secara acak oleh karena kesetimbangan termal. Namun, untuk unsur-unsur tertentu (seperti xenon-129), adalah mungkin untuk memolarisasi keadaan spin nuklir secara signifikan sehingga spin-spin tersebut tersusun berjajar dengan arah yang sama. Kondisi ini disebut sebagai hiperpolarisasi. Fenomena ini memiliki aplikasi yang penting dalam pencitraan resonansi magnetik.[72][73]
Aras-aras energi
Ketika suatu elektron terikat pada sebuah atom, ia memiliki energi potensial yang berbanding terbalik terhadap jarak elektron terhadap inti. Hal ini diukur oleh besarnya energi yang diperlukan untuk melepaskan elektron dari atom dan biasanya diekspresikan dengan satuan elektronvolt (eV). Dalam model mekanika kuantum, elektron-elektron yang terikat hanya dapat menduduki satu set keadaan yang berpusat pada inti, dan tiap-tiap keadaan berkorespondensi terhadap aras energi tertentu. Keadaan energi terendah suatu elektron yang terikat disebut sebagai keadaan dasar, manakala keadaan energi yang lebih tinggi disebut sebagai keadaan tereksitasi.[74]Agar suatu elektron dapat meloncat dari satu keadaan ke keadaan lainnya, ia haruslah menyerap ataupun memancarkan foton pada energi yang sesuai dengan perbedaan energi potensial antar dua aras tersebut. Energi foton yang dipancarkan adalah sebanding dengan frekuensinya.[75] Tiap-tiap unsur memiliki spektrum karakteristiknya masing-masing. Hal ini bergantung pada muatan inti, subkelopak yang terisi dengan elektron, interaksi elektromagnetik antar elektron, dan faktor-faktor lainnya.[76]
Ketika suatu spektrum energi yang berkelanjutan dipancarkan melalui suatu gas ataupun plasma, beberapa foton diserap oleh atom, menyebabkan elektron berpindah aras energi. Elektron yang tereksitasi akan secara spontan memancarkan energi ini sebagai foton dan jatuh kembali ke aras energi yang lebih rendah. Oleh karena itu, atom berperilaku seperti bahan penyaring yang akan membentuk sederetan pita absorpsi. Pengukuran spektroskopi terhadap kekuatan dan lebar pita spektrum mengijinkan penentuan komposisi dan sifat-sifat fisika suatu zat.[77]
Pemantauan cermat pada garis-garis spektrum menunjukkan bahwa beberapa memperlihatkan adanya pemisahan halus. Hal ini terjadi karena kopling spin-orbit yang merupakan interaksi antara spin dengan gerak elektron terluar.[78] Ketika suatu atom berada dalam medan magnet eksternal, garis-garis spektrum terpisah menjadi tiga atau lebih komponen. Hal ini disebut sebagai efek Zeeman. Efek Zeeman disebabkan oleh interaksi medan magnet dengan momen magnetik atom dan elektronnya. Beberapa atom dapat memiliki banyak konfigurasi elektron dengan aras energi yang sama, sehingga akan tampak sebagai satu garis spektrum. Interaksi medan magnet dengan atom akan menggeser konfigurasi-konfigurasi elektron menuju aras energi yang sedikit berbeda, menyebabkan garis spektrum berganda.[79] Keberadaan medan listrik eksternal dapat menyebabkan pemisahan dan pergeseran garis spektrum dengan mengubah aras energi elektron. Fenomena ini disebut sebagai efek Stark.[80]
Valensi dan perilaku ikatan
Kelopak atau kulit elektron terluar suatu atom dalam keadaan yang tak terkombinasi disebut sebagai kelopak valensi dan elektron dalam kelopak tersebut disebut elektron valensi. Jumlah elektron valensi menentukan perilaku ikatan atom tersebut dengan atom lainnya. Atom cenderung bereaksi dengan satu sama lainnya melalui pengisian (ataupun pengosongan) elektron valensi terluar atom.[81] Ikatan kimia dapat dilihat sebagai transfer elektron dari satu atom ke atom lainnya, seperti yang terpantau pada natrium klorida dan garam-garam ionik lainnya. Namun, banyak pula unsur yang menunjukkan perilaku valensi berganda, atau kecenderungan membagi elektron dengan jumlah yang berbeda pada senyawa yang berbeda. Sehingga, ikatan kimia antara unsur-unsur ini cenderung berupa pembagian elektron daripada transfer elektron. Contohnya meliputi unsur karbon dalam senyawa organik.[82]Unsur-unsur kimia sering ditampilkan dalam tabel periodik yang menampilkan sifat-sifat kimia suatu unsur yang berpola. Unsur-unsur dengan jumlah elektron valensi yang sama dikelompokkan secara vertikel (disebut golongan). Unsur-unsur pada bagian terkanan tabel memiliki kelopak terluarnya terisi penuh, menyebabkan unsur-unsur tersebut cenderung bersifat inert (gas mulia).[83][84]
Keadaan

Gambaran pembentukan kondensat Bose-Einstein.
Pada suhu mendekati nol mutlak, atom dapat membentuk kondensat Bose-Einstein, di mana efek-efek mekanika kuantum yang biasanya hanya terpantau pada skala atom terpantau secara makroskopis.[87][88] Kumpulan atom-atom yang dilewat-dinginkan ini berperilaku seperti satu atom super.[89]
Identifikasi
Mikroskop penerowongan payaran (scanning tunneling microscope) adalah suatu mikroskop yang digunakan untuk melihat permukaan suatu benda pada tingkat atom. Alat ini menggunakan fenomena penerowongan kuantum yang mengijinkan partikel-partikel menembus sawar yang biasanya tidak dapat dilewati.Sebuah atom dapat diionisasi dengan melepaskan satu elektronnya. Muatan yang ada menyebabkan trayektori atom melengkung ketika ia melalui sebuah medan magnet. Jari-jari trayektori ion tersebut ditentukan oleh massa atom. Spektrometer massa menggunakan prinsip ini untuk menghitung rasio massa terhadap muatan ion. Apabila sampel tersebut mengandung sejumlah isotop, spektrometer massa dapat menentukan proporsi tiap-tiap isotop dengan mengukur intensitas berkas ion yang berbeda. Teknik untuk menguapkan atom meliputi spektroskopi emisi atomik plasma gandeng induktif (inductively coupled plasma atomic emission spectroscopy) dan spektrometri massa plasma gandeng induktif (inductively coupled plasma mass spectrometry), keduanya menggunakan plasma untuk menguapkan sampel analisis.[90]
Metode lainnya yang lebih selektif adalah spektroskopi pelepasan energi elektron (electron energy loss spectroscopy), yang mengukur pelepasan energi berkas elektron dalam suatu mikroskop elektron transmisi ketika ia berinteraksi dengan sampel. Tomografi kuar atom memiliki resolusi sub-nanometer dalam 3-D dan dapat secara kimiawi mengidentifikasi atom-atom individu menggunakan spektrometri massa waktu lintas.[91]
Spektrum keadaan tereksitasi dapat digunakan untuk menganalisa komposisi atom bintang yang jauh. Panjang gelombang cahaya tertentu yang dipancarkan oleh bintang dapat dipisahkan dan dicocokkan dengan transisi terkuantisasi atom gas bebas. Warna bintang kemudian dapat direplikasi menggunakan lampu lucutan gas yang mengandung unsur yang sama.[92] Helium pada Matahari ditemukan dengan menggunakan cara ini 23 tahun sebelum ia ditemukan di Bumi.[93]
Asal usul dan kondisi sekarang
Atom menduduki sekitar 4% densitas energi total yang ada dalam alam semesta terpantau, dengan densitas rata-rata sekitar 0,25 atom/m3.[94] Dalam galaksi Bima Sakti, atom memiliki konsentrasi yang lebih tinggi, dengan densitas materi dalam medium antarbintang berkisar antara 105 sampai dengan 109 atom/m3.[95] Matahari sendiri dipercayai berada dalam Gelembung Lokal, yaitu suatu daerah yang mengandung banyak gas ion, sehingga densitas di sekelilingnya adalah sekitar 103 atom/m3.[96] Bintang membentuk awan-awan padat dalam medium antarbintang, dan proses evolusioner bintang akan menyebabkan peningkatan kandungan unsur yang lebih berat daripada hidrogen dan helium dalam medium antarbintang. Sampai dengan 95% atom Bima Sakti terkonsentrasi dalam bintang-bintang, dan massa total atom ini membentuk sekitar 10% massa galaksi.[97] Massa sisanya adalah materi gelap yang tidak diketahui dengan jelas.[98]Nukleosintesis
Isotop seperti litium-6 dihasilkan di ruang angkasa melalui spalasi sinar kosmis.[104] Hal ini terjadi ketika sebuah proton berenergi tinggi menumbuk inti atom, menyebabkan sejumlah besar nukleon berhamburan. Unsur yang lebih berat daripada besi dihasilkan di supernova melalui proses r dan di bintang-bintang AGB melalui proses s. Kedua-duanya melibatkan penangkapan neutron oleh inti atom.[105] Unsur-unsur seperti timbal kebanyakan dibentuk melalui peluruhan radioaktif unsur-unsur lain yang lebih berat.[106]
Bumi
Kebanyakan atom yang menyusun Bumi dan termasuk pula seluruh makhluk hidupnya pernah berada dalam bentuk yang sekarang di nebula yang runtuh dari awan molekul dan membentuk Tata Surya. Sisanya merupakan akibat dari peluruhan radioaktif dan proporsinya dapat digunakan untuk menentukan usia Bumi melalui penanggalan radiometrik.[107][108] Kebanyakan helium dalam kerak Bumi merupakan produk peluruhan alfa.[109]Terdapat sekelumit atom di Bumi yang pada awal pembentukannya tidak ada dan juga bukan merupakan akibat dari peluruhan radioaktif. Karbon-14 secara berkesinambungan dihasilkan oleh sinar kosmik di atmosfer.[110] Beberapa atom di Bumi secara buatan dihasilkan oleh reaktor ataupun senjata nuklir.[111][112] Dari semua Unsur-unsur transuranium yang bernomor atom lebih besar daripada 92, hanya plutonium dan neptunium sajalah yang terdapat di Bumi secara alami.[113][114] Unsur-unsur transuranium memiliki waktu paruh radioaktif yang lebih pendek daripada umur Bumi[115], sehingga unsur-unsur ini telah lama meluruh. Pengecualian terdapat pada plutonium-244 yang kemungkinan tersimpan dalam debu kosmik.[107] Kandungan alami plutonium dan neptunium dihasilkan dari penangkapan neutron dalam bijih uranium.[116]
Bumi mengandung sekitar 1,33 × 1050 atom.[117] Pada atmosfer planet, terdapat sejumlah kecil atom gas mulia seperti argon dan neon. Sisa 99% atom pada atmosfer bumi terikat dalam bentuk molekul, misalnya karbon dioksida, oksigen diatomik, dan nitrogen diatomik. Pada permukaan Bumi, atom-atom saling berikatan membentuk berbagai macam senyawa, meliputi air, garam, silikat, dan oksida. Atom juga dapat bergabung membentuk bahan-bahan yang tidak terdiri dari molekul, contohnya kristal dan logam padat ataupun cair.[118][119]
Bentuk teoritis dan bentuk langka

Pencitraan 3-Dimensi keberadaan "Pulau stabilitas" di bagian paling kanan
Tiap-tiap partikel materi memiliki partikel antimaterinya masing-masing dengan muatan listrik yang berlawanan. Sehingga, positron adalah antielektron yang bermuatan positif, dan antiproton adalah proton yang bermuatan negatif, Ketika materi dan antimateri bertemu, keduanya akan saling memusnahkan. Terdapat ketidakseimbangan antara jumlah partikel materi dan antimateri. Ketidakseimbangan ini masih belum dipahami secara menyeluruh, walaupun terdapat teori bariogenesis yang memberikan penjelasan yang memungkinkan. Antimateri tidak pernah ditemukan secara alami.[122][123] Namun, pada tahun 1996, antihidrogen berhasil disintesis di laboratorium CERN di Jenewa.[124][125]
Terdapat pula atom-atom langka lainnya yang dibuat dengan menggantikan satu proton, neutron, ataupun elektron dengan partikel lain yang bermuatan sama. Sebagai contoh, elektron dapat digantikan dengan muon yang lebih berat, membentuk atom muon. Jenis atom ini dapat digunakan untuk menguji prediksi fisika.[126][127][128]
Lihat pula
Catatan
- ^ Kebanyakan
isotop mempunyai jumlah nukleon lebih banyak dari jumlah elektron.
Dalam kasus hydrogen-1, yang mempunyai satu elektron and satu nukleon,
protonnya
 , atau 99,95% dari total massa atom.
, atau 99,95% dari total massa atom. - ^ Satu karat sama dengan 200 miligram. Berdasarkan definisi, karbon-12 memiliki 0,012 kg per mol. Tetapan Avogadro sekitar 6 × 1023 atom per mol.
Referensi
- ^ a b Haubold, Hans (1998). "Microcosmos: From Leucippus to Yukawa". Structure of the Universe. Common Sense Science. Diakses pada 17 Januari 2008.
- ^ Staff (2007-08-01). "Radioactive Decays". Stanford Linear Accelerator Center, Stanford University. Diakses pada 2 Januari 2007.
- ^ a b Ponomarev (1993:14-15).
- ^ a b (Inggris)A. Pablo Iannone. Dictionary of World Philosophy. hlm. 62. ISBN 0-415-17995-5. Diakses pada 9 Juni 2010.
- ^ (Inggris)Hajime Nakamura (1992). A comparative history of ideas. Shri Jainendra Press. hlm. 145. ISBN 81-208-1004-x. Diakses pada 9 Juni 2010.
- ^ (Inggris)Ben-Ami Scharfstein (1998). A comparative history of world philosophy: from the Upanishads to Kant. State University of New York Press. hlm. 189. ISBN 0-7914-3683-7. Diakses pada 9 Juni 2010.
- ^ Siegfried (2002:42–55).
- ^ "Lavoisier's Elements of Chemistry". Elements and Atoms. Le Moyne College, Department of Chemistry. Diakses pada 18 Desember 2007.
- ^ Wurtz (1881:1–2).
- ^ Dalton (1808).
- ^ Einstein, Albert (May 1905). "Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen" (dalam bahasa German) (PDF). Annalen der Physik 322 (8): 549–560. doi:10.1002/andp.19053220806. Diakses pada 4 Februari 2007.
- ^ Mazo (2002:1–7).
- ^ Lee, Y. K. (1995). "Brownian Motion". Imperial College, London. Diakses pada 18 Desember 2007.
- ^ Patterson, Gary (2007). "Jean Perrin and the triumph of the atomic doctrine". Endeavour 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003. Diakses pada 7 November 2008.
- ^ The Nobel Foundation (1906). "J.J. Thomson". Nobelprize.org. Diakses pada 20 Desember 2007.
- ^ "Frederick Soddy, The Nobel Prize in Chemistry 1921". Nobel Foundation. Diakses pada 18 Januari 2008.
- ^ Thomson, Joseph John (1913). "Rays of positive electricity". Proceedings of the Royal Society A 89: 1–20. Diakses pada 18 Januari 2007.
- ^ Stern, David P. (May 16, 2005). "The Atomic Nucleus and Bohr's Early Model of the Atom". NASA Goddard Space Flight Center. Diakses pada 20 Desember 2007.
- ^ Bohr, Niels (December 11, 1922). "Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture". The Nobel Foundation. Diakses pada 16 Februari 2008.
- ^ Lewis, Gilbert N. (April 1916). "The Atom and the Molecule". Journal of the American Chemical Society 38 (4): 762–786. doi:10.1021/ja02261a002.
- ^ Scerri, Eric R. (2007). The Periodic Table. Oxford University Press US. hlm. 205–226. ISBN 0195305736.
- ^ Scully, Marlan O. (June 1987). "On the theory of the Stern-Gerlach apparatus". Foundations of Physics 17 (6): 575–583. doi:10.1007/BF01882788.
- ^ Brown, Kevin (2007). "The Hydrogen Atom". MathPages. Diakses pada 21 Desember 2007.
- ^ Harrison, David M. (March 2000). "The Development of Quantum Mechanics". University of Toronto. Diakses pada 21 Desember 2007.
- ^ Aston, Francis W. (1920). "The constitution of atmospheric neon". Philosophical Magazine 39 (6): 449–55.
- ^ Chadwick, James (December 12, 1935). "Nobel Lecture: The Neutron and Its Properties". Nobel Foundation. Diakses pada 21 Desember 2007.
- ^ Kullander, Sven (August 28, 2001). "Accelerators and Nobel Laureates". The Nobel Foundation. Diakses pada 31 Januari 2008.
- ^ Staff (October 17, 1990). "The Nobel Prize in Physics 1990". The Nobel Foundation. Diakses pada 31 Januari 2008.
- ^ Staff (October 15, 1997). "The Nobel Prize in Physics 1997". Nobel Foundation. Diakses pada 10 Februari 2008.
- ^ Park, Jiwoong et al (2002). "Coulomb blockade and the Kondo effect in single-atom transistors". Nature 417 (6890): 722–25. doi:10.1038/nature00791. Diakses pada 3 Januari 2008.
- ^ Domokos, P. (1994). "Single-atom interference method for generating Fock states". Physical Review a 50: 3340–44. doi:10.1103/PhysRevA.50.3340. Diakses pada 3 Januari 2008.
- ^ Demtröder (2002:39–42).
- ^ Woan (2000:8).
- ^ Particle Data Group (2002). "The Particle Adventure". Lawrence Berkeley Laboratory. Diakses pada 3 Januari 2007.
- ^ Schombert, James (April 18, 2006). "Elementary Particles". University of Oregon. Diakses pada 3 Januari 2007.
- ^ (Inggris) Basic Knowledge of Radiation and Radioisotopes (Scientific Basis, Safe Handling of Radioisotopes and Radiation Protection). Japan Radioisotope Association. 5 November 2005. ISBN 4-89073-170-9 C2040.
- ^ Jevremovic (2005:63).
- ^ Pfeffer (2000:330–336).
- ^ Wenner, Jennifer M. (October 10, 2007). "How Does Radioactive Decay Work?". Carleton College. Diakses pada 9 Januari 2008.
- ^ a b c Raymond, David (April 7, 2006). "Nuclear Binding Energies". New Mexico Tech. Diakses pada 3 Januari 2007.
- ^ Mihos, Chris (July 23, 2002). "Overcoming the Coulomb Barrier". Case Western Reserve University. Diakses pada 13 Februari 2008.
- ^ Staff (March 30, 2007). "ABC's of Nuclear Science". Lawrence Berkeley National Laboratory. Diakses pada 3 Januari 2007.
- ^ Makhijani, Arjun (March 2, 2001). "Basics of Nuclear Physics and Fission". Institute for Energy and Environmental Research. Diakses pada 3 Januari 2007.
- ^ Shultis et al. (2002:72–6).
- ^ Fewell, M. P. (1995). "The atomic nuclide with the highest mean binding energy". American Journal of Physics 63 (7): 653–58. doi:10.1119/1.17828. Diakses pada 1 Februari 2007.
- ^ Mulliken, Robert S. (1967). "Spectroscopy, Molecular Orbitals, and Chemical Bonding". Science 157 (3784): 13–24. doi:10.1126/science.157.3784.13. PMID 5338306.
- ^ a b Brucat, Philip J. (2008). "The Quantum Atom". University of Florida. Diakses pada 4 Januari 2007.
- ^ Herter, Terry (2006). "Lecture 8: The Hydrogen Atom". Cornell University. Diakses pada 14 Februari 2008.
- ^ Bell, R. E. (1950). "Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron". Physical Review 79 (2): 282–285. doi:10.1103/PhysRev.79.282.
- ^ Smirnov (2003:249–72).
- ^ Matis, Howard S. (August 9, 2000). "The Isotopes of Hydrogen". Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab. Diakses pada 21 Desember 2007.
- ^ a b Sills (2003:131–134).
- ^ Dumé, Belle, "Bismuth breaks half-life record for alpha decay ", (Physics World), 23 April 2003. Diakses pada 21 Desember 2007.
- ^ Lindsay, Don (July 30, 2000). "Radioactives Missing From The Earth". Don Lindsay Archive. Diakses pada 23 Mei 2007.
- ^ CRC Handbook (2002).
- ^ a b Mills et al. (1993).
- ^ Chieh, Chung (January 22, 2001). "Nuclide Stability". University of Waterloo. Diakses pada 4 Januari 2007.
- ^ "Atomic Weights and Isotopic Compositions for All Elements". National Institute of Standards and Technology. Diakses pada 4 Januari 2007.
- ^ Audi, G. (2003). "The Ame2003 atomic mass evaluation (II)". Nuclear Physics A 729: 337–676. doi:10.1016/j.nuclphysa.2003.11.003. Diakses pada 7 Februari 2008.
- ^ Shannon, R. D. (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallographica, Section a 32: 751. doi:10.1107/S0567739476001551. Diakses pada 3 Januari 2007.
- ^ Dong, Judy (1998). "Diameter of an Atom". The Physics Factbook. Diakses pada 19 November 2007.
- ^ Zumdahl (2002).
- ^ Staff (2007). "Small Miracles: Harnessing nanotechnology". Oregon State University. Diakses pada 7 Januari 2007.—describes the width of a human hair as 105 nm and 10 carbon atoms as spanning 1 nm.
- ^ Padilla et al. (2002:32)—"There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen."
- ^ Feynman (1995).
- ^ a b "Radioactivity". Splung.com. Diakses pada 19 Desember 2007.
- ^ L'Annunziata (2003:3–56).
- ^ Firestone, Richard B. (May 22, 2000). "Radioactive Decay Modes". Berkeley Laboratory. Diakses pada 7 Januari 2007.
- ^ Hornak, J. P. (2006). "Chapter 3: Spin Physics". The Basics of NMR. Rochester Institute of Technology. Diakses pada 7 Januari 2007.
- ^ a b Schroeder, Paul A. (February 25, 2000). "Magnetic Properties". University of Georgia. Diakses pada 7 Januari 2007.
- ^ Goebel, Greg (September 1, 2007). "[4.3] Magnetic Properties of the Atom". Elementary Quantum Physics. In The Public Domain website. Diakses pada 7 Januari 2007.
- ^ Yarris, Lynn (Spring 1997). "Talking Pictures". Berkeley Lab Research Review. Diakses pada 9 Januari 2008.
- ^ Liang and Haacke (1999:412–26).
- ^ Zeghbroeck, Bart J. Van (1998). "Energy levels". Shippensburg University. Diakses pada 23 Desember 2007.
- ^ Fowles (1989:227–233).
- ^ Martin, W. C. (May 2007). "Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas". National Institute of Standards and Technology. Diakses pada 8 Januari 2007.
- ^ "Atomic Emission Spectra — Origin of Spectral Lines". Avogadro Web Site. Diakses pada 10 Agustus 2006.
- ^ Fitzpatrick, Richard (February 16, 2007). "Fine structure". University of Texas at Austin. Diakses pada 14 Februari 2008.
- ^ Weiss, Michael (2001). "The Zeeman Effect". University of California-Riverside. Diakses pada 6 Februari 2008.
- ^ Beyer (2003:232–236).
- ^ Reusch, William (July 16, 2007). "Virtual Textbook of Organic Chemistry". Michigan State University. Diakses pada 11 Januari 2008.
- ^ "Covalent bonding - Single bonds". chemguide. 5 November 2000.
- ^ Husted, Robert et al. (December 11, 2003). "Periodic Table of the Elements". Los Alamos National Laboratory. Diakses pada 11 Januari 2008.
- ^ Baum, Rudy (2003). "It's Elemental: The Periodic Table". Chemical & Engineering News. Diakses pada 11 Januari 2008.
- ^ Goodstein (2002:436–438).
- ^ Brazhkin, Vadim V. (2006). "Metastable phases, phase transformations, and phase diagrams in physics and chemistry". Physics-Uspekhi 49: 719–24. doi:10.1070/PU2006v049n07ABEH006013.
- ^ Myers (2003:85).
- ^ Staff. "Bose-Einstein Condensate: A New Form of Matter ", (National Institute of Standards and Technology), 9 Oktober 2001. Diakses pada 16 Januari 2008.
- ^ Colton, Imogen (February 3, 1999). "Super Atoms from Bose-Einstein Condensation". The University of Melbourne. Diakses pada 6 Februari 2008.
- ^ Jakubowski, N. (1998). "Sector field mass spectrometers in ICP-MS". Spectrochimica Acta Part B: Atomic Spectroscopy 53 (13): 1739–63. doi:10.1016/S0584-8547(98)00222-5.
- ^ Müller, Erwin W.; Panitz, John A.; McLane, S. Brooks (1968). "The Atom-Probe Field Ion Microscope". Review of Scientific Instruments 39 (1): 83–86. doi:10.1063/1.1683116. ISSN 0034-6748.
- ^ Lochner, Jim (April 30, 2007). "What Do Spectra Tell Us?". NASA/Goddard Space Flight Center. Diakses pada 3 Januari 2008.
- ^ Winter, Mark (2007). "Helium". WebElements. Diakses pada 3 Januari 2008.
- ^ Hinshaw, Gary (February 10, 2006). "What is the Universe Made Of?". NASA/WMAP. Diakses pada 7 Januari 2008.
- ^ Choppin et al. (2001).
- ^ Davidsen, Arthur F. (1993). "Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission". Science 259 (5093): 327–34. doi:10.1126/science.259.5093.327. PMID 17832344. Diakses pada 7 Januari 2008.
- ^ Lequeux (2005:4).
- ^ Smith, Nigel (January 6, 2000). "The search for dark matter". Physics World. Diakses pada 14 Februari 2008.
- ^ Croswell, Ken (1991). "Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium". New Scientist (1794): 42. Diakses pada 14 Januari 2008.
- ^ Copi, Craig J. (1995). "Big-Bang Nucleosynthesis and the Baryon Density of the Universe" (PDF). Science 267: 192–99. doi:10.1126/science.7809624. PMID 7809624. Diakses pada 13 Januari 2008.
- ^ Hinshaw, Gary (December 15, 2005). "Tests of the Big Bang: The Light Elements". NASA/WMAP. Diakses pada 13 Januari 2008.
- ^ Abbott, Brian (May 30, 2007). "Microwave (WMAP) All-Sky Survey". Hayden Planetarium. Diakses pada 13 Januari 2008.
- ^ F. Hoyle (1946). "The synthesis of the elements from hydrogen". Monthly Notices of the Royal Astronomical Society 106: 343–83. Diakses pada 13 Januari 2008.
- ^ Knauth, D. C. (2000). "Newly synthesized lithium in the interstellar medium". Nature 405: 656–58. doi:10.1038/35015028.
- ^ Mashnik, Stepan G. (August 2000). "On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes". Cornell University. Diakses pada 14 Januari 2008.
- ^ Kansas Geological Survey (May 4, 2005). "Age of the Earth". University of Kansas. Diakses pada 14 Januari 2008.
- ^ a b Manuel (2001:407–430,511–519).
- ^ Dalrymple, G. Brent (2001). "The age of the Earth in the twentieth century: a problem (mostly) solved". Geological Society, London, Special Publications 190: 205–21. doi:10.1144/GSL.SP.2001.190.01.14. Diakses pada 14 Januari 2008.
- ^ Anderson, Don L. (September 2, 2006). "Helium: Fundamental models". MantlePlumes.org. Diakses pada 14 Januari 2007.
- ^ Pennicott, Katie, "Carbon clock could show the wrong time ", (PhysicsWeb), 10 Mei 2001. Diakses pada 14 Januari 2008.
- ^ Yarris, Lynn, "New Superheavy Elements 118 and 116 Discovered at Berkeley Lab ", (Berkeley Lab), 27 Juli 2001. Diakses pada 14 Januari 2008.
- ^ Diamond, H. et al. (1960). "Heavy Isotope Abundances in Mike Thermonuclear Device" (subscription required). Physical Review 119: 2000–04. doi:10.1103/PhysRev.119.2000. Diakses pada 14 Januari 2008.
- ^ Poston Sr., John W. (March 23, 1998). "Do transuranic elements such as plutonium ever occur naturally?". Scientific American. Diakses pada 15 Januari 2008.
- ^ Keller, C. (1973). "Natural occurrence of lanthanides, actinides, and superheavy elements". Chemiker Zeitung 97 (10): 522–30. Diakses pada 15 Januari 2008.
- ^ Marco (2001:17).
- ^ "Oklo Fossil Reactors". Curtin University of Technology. Diakses pada 15 Januari 2008.
- ^ Weisenberger, Drew. "How many atoms are there in the world?". Jefferson Lab. Diakses pada 16 Januari 2008.
- ^ Pidwirny, Michael. "Fundamentals of Physical Geography". University of British Columbia Okanagan. Diakses pada 16 Januari 2008.
- ^ Anderson, Don L. (2002). "The inner inner core of Earth". Proceedings of the National Academy of Sciences 99 (22): 13966–68. doi:10.1073/pnas.232565899. PMID 12391308. Diakses pada 16 Januari 2008.
- ^ Anonymous (October 2, 2001). "Second postcard from the island of stability". CERN Courier. Diakses pada 14 Januari 2008.
- ^ Jacoby, Mitch (2006). "As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine". Chemical & Engineering News 84 (10): 19. Diakses pada 14 Januari 2008.
- ^ Koppes, Steve, "Fermilab Physicists Find New Matter-Antimatter Asymmetry ", (University of Chicago), 1 Maret 1999. Diakses pada 14 Januari 2008.
- ^ Cromie, William J., "A lifetime of trillionths of a second: Scientists explore antimatter ", (Harvard University Gazette), 16 Agustus 2001. Diakses pada 14 Januari 2008.
- ^ Hijmans, Tom W. (2002). "Particle physics: Cold antihydrogen". Nature 419: 439–40. doi:10.1038/419439a.
- ^ Staff. "Researchers 'look inside' antimatter ", (BBC News), 30 Oktober 2002. Diakses pada 14 Januari 2008.
- ^ Barrett, Roger (1990). "The Strange World of the Exotic Atom". New Scientist (1728): 77–115. Diakses pada 4 Januari 2008.
- ^ Indelicato, Paul (2004). "Exotic Atoms". Physica Scripta T112: 20–26. doi:10.1238/Physica.Topical.112a00020.
- ^ Ripin, Barrett H. (July 1998). "Recent Experiments on Exotic Atoms". American Physical Society. Diakses pada 15 Februari 2008.
Referensi buku
- L'Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. ISBN 0124366031. OCLC 162129551.
- Beyer, H. F. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. ISBN 0750304812. OCLC 47150433.
- Choppin, Gregory R. (2001). Radiochemistry and Nuclear Chemistry. Elsevier. ISBN 0750674636. OCLC 162592180.
- Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell.
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (edisi ke-1st). Springer. ISBN 3540206310. OCLC 181435713.
- Feynman, Richard (1995). Six Easy Pieces. The Penguin Group. ISBN 978-0-140-27666-4. OCLC 40499574.
- Fowles, Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. ISBN 0486659577. OCLC 18834711.
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 0-391-02177-X. OCLC 10916778.
- Goodstein, David L. (2002). States of Matter. Courier Dover Publications. ISBN 0-486-49506-X.
- Harrison, Edward Robert (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. Cambridge University Press. ISBN 0521773512. OCLC 50441595.
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. Routledge. ISBN 0415179955. OCLC 44541769.
- Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. ISBN 0387232842. OCLC 228384008.
- Lequeux, James (2005). The Interstellar Medium. Springer. ISBN 3540213260. OCLC 133157789.
- Levere, Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. The Johns Hopkins University Press. ISBN 0-8018-6610-3.
- Liang, Z.-P. (1999). Webster, J. G.. ed (PDF). Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. vol. 2. John Wiley & Sons. hlm. 412–26. ISBN 0471139467. Diakses pada 9 Januari 2008.
- MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. ISBN 0195218337. OCLC 223372888.
- Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 0306465620. OCLC 228374906.
- Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. ISBN 0198515677. OCLC 48753074.
- Mills, Ian (1993). Quantities, Units and Symbols in Physical Chemistry (edisi ke-2nd). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. ISBN 0-632-03583-8. OCLC 27011505.
- Moran, Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. Harvard University Press. ISBN 0674014952.
- Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. ISBN 0313316643. OCLC 50164580.
- Padilla, Michael J. (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc.. ISBN 0-13-054091-9. OCLC 47925884.
- Pauling, Linus (1960). The Nature of the Chemical Bond. Cornell University Press. ISBN 0801403332. OCLC 17518275.
- Pfeffer, Jeremy I. (2000). Modern Physics: An Introductory Text. Imperial College Press. ISBN 1860942504. OCLC 45900880.
- Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. CRC Press. ISBN 0750302518. OCLC 26853108.
- Scerri, Eric R. (2007). The Periodic Table. Oxford University Press. ISBN 0195305736.
- Shultis, J. Kenneth (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. ISBN 0824708342. OCLC 123346507.
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 0871699249. OCLC 186607849.
- Sills, Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. ISBN 0764121464. OCLC 51543743.
- Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. ISBN 0-387-95550-X.
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. hlm. 213–214. ISBN 074324379X.
- Various (2002). Lide, David R.. ed. Handbook of Chemistry & Physics (edisi ke-88th). CRC. ISBN 0849304865. OCLC 179976746. Diakses pada 23 Mei 2008.
- Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. ISBN 0521575079. OCLC 224032426.
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company.
- Zaider, Marco (2001). Radiation Science for Physicians and Public Health Workers. Springer. ISBN 0306464039. OCLC 44110319.
- Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (edisi ke-5th). Houghton Mifflin. ISBN 0-618-34342-3. OCLC 173081482. Diakses pada 5 Februari 2008.
Subscribe to:
Posts (Atom)